Aspects théoriques de la réduction des oxydes par CO
Pour l'utilisation du diagramme d'Ellingham, des explications complémentaires sont disponibles en Annexe.
Les oxydes de fer et les oxydes de carbone
Le diagramme d'Ellingham du fer et du carbone
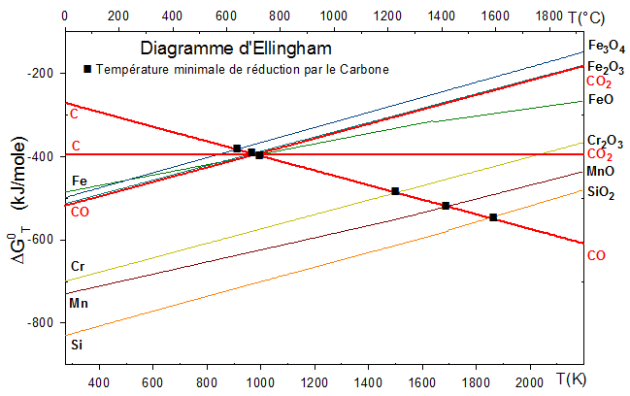
Les oxydes de fer et les oxydes de carbone
Toutes les droites représentatives des oxydes ont une pente positive
sauf celle conduisant à la formation de CO car CO possède un caractère réducteur vis à vis des oxydes de fer.
On voit donc que CO est la forme prépondérante des oxydes de carbone à haute température puisque $\left| \text{ }\!\!\Delta\!\!\text{ G}_{\text{T}}^{\text{0}} \right|$ diminue quand T augmente.
CO est donc un oxyde plus réducteur que $\text{FeO}\text{, F}{{\text{e}}_{\text{2}}}{{\text{O}}_{\text{3}}}\text{ et F}{{\text{e}}_{\text{3}}}{{\text{O}}_{\text{4}}}$ (de même pour MnO).
Dans l'affinage de la fonte :
L'addition de ${{\text{O}}_{\text{2}}}$ (à T=1500-1600°C) sur une fonte oxydera d'abord le métal le plus réducteur : C, Si, Mn,...puis Fe
C est plus réducteur que les métaux Fe, Si, Mn,... au delà des points de rencontre des droites $\text{ }\!\!\Delta\!\!\text{ G}_{\text{T}}^{\text{0}}$ ,
à température élevée : $MO+C\to M+CO$
Domaine d'existence des oxydes de carbone
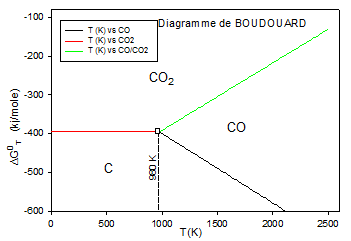
d'après le diagramme d'Ellingham du carbone, 3 équilibres peuvent exister (valeurs en kJ/mole).
$\begin{align}& \,\,\,\,\,\,C+{{O}_{2}}\,_{\to }^{\leftarrow }\,C{{O}_{2}}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\Delta G_{1}^{0}=-399.13-2.48*{{10}^{-3}}T \\& 2CO+{{O}_{2}}\,_{\to }^{\leftarrow }\,2C{{O}_{2}}\,\,\,\,\,\,\,\,\,\,\,\,\Delta G_{2}^{0}=-565.4+0.174\,T \\& \,\,\,\,2C+{{O}_{2}}\,_{\to }^{\leftarrow }\,2CO\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\Delta G_{3}^{0}=-220.9-0.179\,T \\\end{align}$
Les trois droites se coupent à T=980 K
Pour T<980 K, il y a dismutation de CO : $2CO\,_{\to }^{\leftarrow }\,C{{O}_{2}}+C$ : Equilibre de BOUDOUARD
La fraction de CO est plus importante quand la température T est plus élevée.
L'équilibre de BOUDOUARD
$C{{O}_{2}}+C\,{}_{\to }^{\leftarrow }\,2CO\,\,\,\,\,avec\,\,\,\Delta G_{4}^{0}=\Delta G_{3}^{0}-\Delta G_{1}^{0}=172.2-0.177\,T$ , $\Delta G_{4}^{0}$ diminue si T augmente
${{K}_{p}}=\frac{{{({{p}_{CO}})}^{2}}}{{{p}_{C{{O}_{2}}}}*{{P}^{0}}}$ avec $P={{P}_{CO}}\,+{{P}_{C{{O}_{2}}}}$ , (R=8.314 J/K/mole) et ${{\text{P}}^{\text{0}}}$ = Pression de référence (1 atm)
à l'équilibre $$\Delta G_{4}^{0}=-\,RT\,Log\,{{K}_{p}}$$ donc $$\,Log\,{{K}_{p}}=-{}^{\Delta G_{4}^{0}}/{}_{RT}=-\frac{172200}{8.314*T}+\frac{177}{8.314}$$ On peut alors tracer la courbe traduisant l'équilibre de BOUDOUARD $$\,Log\,{{K}_{p}}=-\frac{20712}{T}+21.3$$ En fait, on trace ${{\text{p}}_{\text{CO}}}\text{/P}$ pour une pression totale P donnée. | 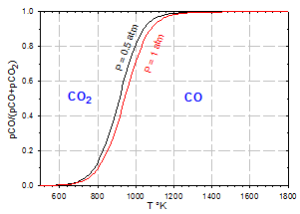 |
Exemple:
à T=900 K, $\,{{K}_{p}}=\exp (-23.01+21.3)=0.18$ et
${{\text{p}}_{\text{CO}}}\text{+}{{\text{p}}_{\text{C}{{\text{O}}_{\text{2}}}}}\text{=0}\text{.5}\text{atm}$,
${{\text{p}}_{\text{CO}}}\text{=0}\text{.223}\text{ atm}\text{ et}\text{ }{{\text{p}}_{\text{C}{{\text{O}}_{\text{2}}}}}\text{=0.277}\text{atm}$,
${{\text{p}}_{\text{CO}}}\text{/}{{\text{p}}_{\text{CO}}}_{\text{2}}\text{=0}\text{.805}\text{ et}\text{ }{{\text{p}}_{\text{CO}}}\text{/P=0.446}$
Fondamental :
$C{{O}_{2}}$ est stable à basse température en présence de carbone
$CO$ est stable à haute température en présence de carbone
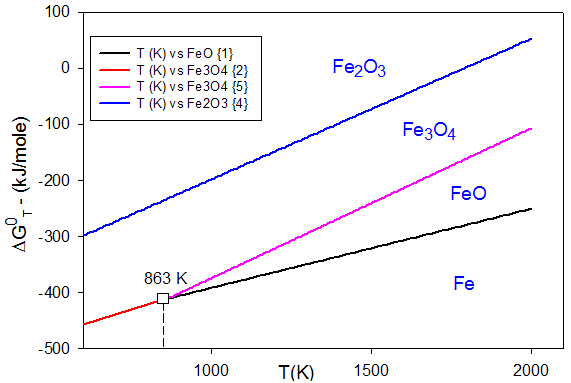
Domaine d'existence des oxydes de fer
$2Fe+{{O}_{2}}\xrightarrow{{{K}_{1}}}2FeO\text{ }\ \ \ \ \text{ }\{\text{ 1 }\}$ avec $\text{ }\!\!\Delta\!\!\text{ G}_{\text{1}}^{\text{0}}\text{=-532}\text{.6+0}\text{.1420*T}$ en kJ/mole
${3}/{2}\;\text{ }Fe+{{O}_{2}}\xrightarrow{{{K}_{2}}}{1}/{2}\;\text{ }F{{e}_{3}}{{O}_{4}}\text{ }\ \ \ \ \text{ }\{\text{ 2 }\}$ avec $\text{ }\!\!\Delta\!\!\text{ G}_{\text{2}}^{\text{0}}\text{=-559}\text{.9+0}\text{.1728*T}$ en kJ/mole
${4}/{3}\;\text{ }Fe+{{O}_{2}}\xrightarrow{{{K}_{3}}}{2}/{3}\;\text{ }F{{e}_{2}}{{O}_{3}}\text{ }\ \ \ \ \text{ }\{\text{ 3 }\}$ avec $\text{ }\!\!\Delta\!\!\text{ G}_{\text{3}}^{\text{0}}\text{=-547}\text{.6+0}\text{.1815*T}$ en kJ/mole
Tous ces équilibres sont monovariants : $v\text{ }=\text{ }n+2-\varphi $ , donc si T=Cste alors P=Cste et inversement : $K=\frac{{{P}^{0}}}{p{{O}_{2}}}$ où ${{P}^{0}}$ est la pression de référence.
D'après le diagramme d'Ellingham, on voit que les droites se coupent donc tous les oxydes ne sont pas stables quelle que soit la température.
à T<863 K : FeO est instable (dismutation) et le diagramme précédent doit être modifié en tenant compte de l'équilibres {4} suivant :
$4F{{e}_{3}}{{O}_{4}}+{{O}_{2}}\xrightarrow{{{K}_{4}}}6F{{e}_{2}}{{O}_{3}}\text{ }\ \ \ \ \text{ }\{\text{ 4 }\}$ avec $\text{ }\!\!\Delta\!\!\text{ G}_{\text{4}}^{\text{0}}\text{=9 }\!\!\Delta\!\!\text{ G}_{\text{3}}^{\text{0}}\text{-8 }\!\!\Delta\!\!\text{ G}_{\text{2}}^{\text{0}}\text{=-449}\text{.0+0}\text{.2511*T}$ en kJ/mole
à T>863 K : il faut tenir tenant compte de l'équilibre {5} suivant :
$6FeO+{{O}_{2}}\xrightarrow{{{K}_{5}}}2F{{e}_{3}}{{O}_{4}}\text{ }\ \ \ \ \text{ }\{\text{ 5 }\}\text{ }$ avec $\text{ }\!\!\Delta\!\!\text{ }\text{G}_{\text{5}}^{\text{0}}\text{=4 }\text{ }\!\!\Delta\!\!\text{ }\text{G}_{\text{2}}^{\text{0}}\text{-3 }\text{ }\!\!\Delta\!\!\text{ }\text{G}_{\text{1}}^{\text{0}}\text{=-641}\text{.8+0}\text{.2677*T}$ en kJ/mole
On obtient ainsi le diagramme suivant pour ${{\text{p}}_{{{\text{O}}_{\text{2}}}}}\text{=1 atm}$. C'est le diagramme de CHAUDRON
A T<863 K : $4FeO\,_{\to \,}^{\leftarrow }Fe+F{{e}_{3}}{{O}_{4}}$, donc FeO est thermodynamiquement instable à basse température.
Réduction des oxydes de fer par l'oxyde de carbone
A T>1000 K, le réducteur est CO gaz.
Réduction de $\text{F}{{\text{e}}_{\text{2}}}{{\text{O}}_{\text{3}}}$ $3\,F{{e}_{2}}{{O}_{3}}+CO\,_{\to }^{\leftarrow }\,2\,F{{e}_{3}}{{O}_{4}}+C{{O}_{2}}\,\,\,\,\,\,\,\,\,\Delta G_{T}^{0}$
Réaction totale si T>500 K, car ${{K}_{p}}=\frac{{{p}_{CO}}_{2}}{{{p}_{CO}}}>>1$
(à l'équilibre $\,\Delta G_{T}^{0}=-RT*Log{{K}_{p}}$ et ${{K}_{p(500)}}=\exp ({}^{-\Delta G_{500}^{0}}/{}_{RT})\approx {{10}^{8}}$
car $\text{ }\!\!\Delta\!\!\text{ G}_{\text{T}}^{\text{0}}\text{=-58}\text{.18-0}\text{.0385*T}\text{=2}\text{ }\!\!\Delta\!\!\text{ G}_{\text{F}{{\text{e}}_{\text{3}}}{{\text{O}}_{\text{4}}}}^{\text{0}}\text{+ }\!\!\Delta\!\!\text{ G}_{\text{C}{{\text{O}}_{\text{2}}}}^{\text{0}}\text{-3 }\!\!\Delta\!\!\text{ G}_{\text{F}{{\text{e}}_{\text{2}}}{{\text{O}}_{\text{3}}}}^{\text{0}}\text{- }\!\!\Delta\!\!\text{ G}_{\text{CO}}^{\text{0}}$ en kJ/mole.
Réduction de $\text{F}{{\text{e}}_{\text{3}}}{{\text{O}}_{\text{4}}}$
Si T<863 K $1/4\text{ }F{{e}_{3}}{{O}_{4}}+CO_{\to }^{\leftarrow }3/4\ Fe+C{{O}_{2}}\Delta G_{T}^{0}=-2.74+6.3*{{10}^{-4}}*T$
cet équilibre est déplacé vers la droite par une diminution de température
Si T>863 K $F{{e}_{3}}{{O}_{4}}+CO\,\,_{\to }^{\leftarrow }3\,FeO+C{{O}_{2}}\,\,\,\,\,\,\,\,\,\Delta G_{T}^{0}=38.2-0.0488*T$
cet équilibre est déplacé vers la droite par une augmentation de température
puis $FeO+CO\,\,_{\to }^{\leftarrow }\,Fe+C{{O}_{2}}\,\,\,\,\,\,\,\,\,\Delta G_{T}^{0}=-16.4+0.0165*T$
cet équilibre est déplacé vers la droite par une diminution de température
Le résultat global de la réduction se lit sur le diagramme $\frac{{{p}_{CO}}}{{{p}_{CO}}+{{p}_{CO}}_{2}}=f(T)$
(superposition du diagramme de CHAUDRON et de BOUDOUARD).
Pour T donné, l'équilibre est atteint pour un rapport ${{\text{p}}_{\text{CO}}}\text{/P}$ donné. Si on maintient ce rapport et si on modifie T, l'équilibre est modifié avec disparition d'une phase.
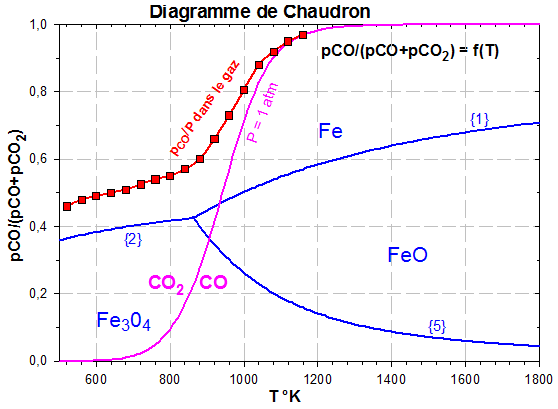
Exemple :
à 800 K, l'équilibre ${1}/{4}\;F{{e}_{3}}{{O}_{4}}+CO\text{ }\rightleftarrows \text{ }{3}/{4}\;Fe+C{{O}_{2}}$ est atteint pour ${{\text{p}}_{\text{CO}}}\text{/P=0}\text{.42}$
A ${{\text{p}}_{\text{CO}}}\text{/P=Cste}$, si on augmente T alors $\left| \text{ }\!\!\Delta\!\!\text{ G}_{\text{T}}^{\text{0}} \right|$ augmente et l'équilibre est déplacé vers la gauche, le fer est consommé pour donner $\text{F}{{\text{e}}_{\text{3}}}{{\text{O}}_{\text{4}}}$ (devenu l'espèce stable).
Par contre, si on augmente ${{\text{p}}_{\text{CO}}}\text{/P}$ à T=Cste , on favorise la formation de Fe.
Fondamental :
En fait, en raison de la vitesse notable du courant gazeux (CO presque pur en bas du haut-fourneau et de la formation de CO par contact avec le coke), la composition réelle de la phase gazeuse est plus riche que prévue en CO et suit la courbe pointillée indiquée sur le diagramme.
La réduction des oxydes peut alors s'effectuer à des températures inférieures à celles prévues en théorie.
Par exemple : $\text{F}{{\text{e}}_{\text{3}}}{{\text{O}}_{\text{4}}}$ est réduit en Fe dès 800 K




