Produit de solubilité
Dans une solution saturée de chlorure d'argent, AgCl solide coexiste avec AgCl dissous (sous forme$A{{g}^{+}}\text{ }et\text{ }C{{l}^{-}}$ ) :
$$AgC{{l}_{s}}\rightleftarrows A{{g}^{+}}+C{{l}^{-}}\ ,\ \ K=\frac{[A{{g}^{+}}]\cdot [C{{l}^{-}}]}{[AgC{{l}_{s}}]}\ \ mais\ [AgC{{l}_{s}}]=1\ \ d'o\grave{u}\ \ {{K}_{s}}=\ [A{{g}^{+}}]\cdot [C{{l}^{-}}]={{10}^{-9.75}}(p{{K}_{s}}=9.75)$$
Solubilité (dans l'eau pure)
$AgC{{l}_{s}}\rightleftarrows A{{g}^{+}}+C{{l}^{-}}\ \ et\ \ \ [A{{g}^{+}}]=[C{{l}^{-}}]\ \ donc\ \ [A{{g}^{+}}]=\sqrt{{{K}_{s}}}\ \ d'o\grave{u}\ \ \ S=[A{{g}^{+}}]=[C{{l}^{-}}]=\ {{10}^{-4.87}}mole.{{l}^{-1}}$
$Ca{{F}_{2}}_{(s)}\rightleftarrows C{{a}^{2+}}+2{{F}^{-}}\ ,\ {{K}_{s}}=\ \ \ [C{{a}^{2+}}]\cdot {{[{{F}^{-}}]}^{2}}={{10}^{-10.4}}\ ,\ \ [{{F}^{-}}]=2[C{{a}^{2+}}]\ =2\cdot \sqrt[3]{\frac{{{K}_{s}}}{4}}\ \ et\ \ S=2.15\ {{10}^{-4}}mole.{{l}^{-1}}$
Précipitation par excès de réactif
On prend une solution d'ions $A{{g}^{+}}$ et on ajoute des ions $C{{l}^{-}}$ :
- comme ${{K}_{s}}=\ [A{{g}^{+}}]\cdot [C{{l}^{-}}]$ la précipitation commence dès que $\ [A{{g}^{+}}]\cdot [C{{l}^{-}}]\ge {{K}_{s}}$
- la précipitation des ions $A{{g}^{+}}$ sera d'autant plus complète ($A{{g}^{+}}$petit) que $C{{l}^{-}}$ sera grand.
Effet d'ions communs - ions « étrangers » (ou passifs).
C'est le cas si l'on dissout AgCl dans une solution contenant déjà un composé très soluble d'un ion commun (KCl ou $AgN{{O}_{3}}$ par exemple) ; on constate que la solubilité de AgCl diminue.
Soit c la molarité initiale en KCl et ${{S}_{0}}=[A{{g}^{+}}]$ la solubilité dans l'eau pure de AgCl,
la relation d'électroneutralité est : $[C{{l}^{-}}]+[O{{H}^{-}}]=[A{{g}^{+}}]+[{{K}^{+}}]+[{{H}^{+}}]$,
comme la solution est pratiquement neutre $[C{{l}^{-}}]=[A{{g}^{+}}]+[{{K}^{+}}]+[{{H}^{+}}]-[O{{H}^{-}}]\approx S+c$, et ${{K}_{s0}}=S(S+c)$
mais S est petit devant c, il reste : ${{K}_{s0}}\approx S\cdot c$ .
Pour $c={{10}^{-2}}mol.{{l}^{-1}}$ , on aura $S=1.76\text{ }~{{10}^{-8}}mol.{{l}^{-1}}$ au lieu de $1.33\text{ }~{{10}^{-5}}mol.{{l}^{-1}}$ .
Application à la séparation par précipitation
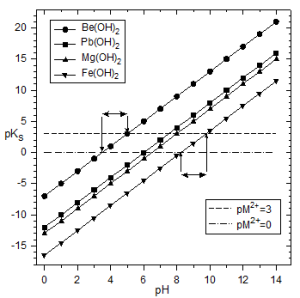
Dans le mélange équimoléculaire d'ions $B{{e}^{2+}},\text{ }M{{g}^{2+}},\text{ }P{{b}^{2+}}\text{ }et\text{ }F{{e}^{2+}}$ ($\ {{[{{M}^{2+}}]}_{initial}}=1$),
quels ions peut-on séparer en les précipitant sous forme d'hydroxyde ?
$Be{{\left( OH \right)}_{2}}$ | $Mg{{\left( OH \right)}_{2}}$ | $Pb{{\left( OH \right)}_{2}}$ | $Fe{{\left( OH \right)}_{2}}$ | |
$p{{K}_{s}}$ | 21 | 11.15 | 16 | 15 |
$\begin{align}& \oplus \ D\acute{e}but\ de\ pr\acute{e}cipitation\ \grave{a}\ \ {}^{[{{M}^{2+}}]}/{}_{[M{{(OH)}_{2}}]}\ge {{10}^{3}}\ \ ou\ \ [{{M}^{2+}}]=0.999\approx 1\ \ donc\ p{{M}^{2+}}=0 \\& \oplus \ Fin\ de\ pr\acute{e}cipitation\ \grave{a}\ \ \ \ \ \ {}^{[{{M}^{2+}}]}/{}_{[M{{(OH)}_{2}}]}\ge {{10}^{-3}}\ \ ou\ \ [{{M}^{2+}}]\approx 0.001\ \ \ \ \ donc\ p{{M}^{2+}}=3 \\\end{align}$ $\begin{align}& M{{(OH)}_{2}}\rightleftarrows {{M}^{2+}}+2O{{H}^{-}}\ \\& {{K}_{s}}=[{{M}^{2+}}]\cdot {{[O{{H}^{-}}]}^{2}}\ \ et\ \ {{K}_{e}}=[{{H}^{+}}]\cdot [O{{H}^{-}}]={{10}^{-14}} \\& [{{M}^{2+}}]=\ \ \frac{{{K}_{s}}\cdot {{[{{H}^{+}}]}^{2}}}{K_{e}^{2}}\ \ on\ \ en\ tire\ \ \\& \ p{{M}^{2+}}=2pH+p{{K}_{s}}-28 \\& Appliqu\acute{e}\ aux\ diff\acute{e}rents\ ions\ :\ \ \ \\& \ \ \ \ \ pB{{e}^{2+}}=2pH-7\ \ \ \ \\& \ \ \ \ pM{{g}^{2+}}=2pH-16.85 \\& \ \ \ \ \ pP{{b}^{2+}}=2pH-12\ \ \\& \ \ \ \ \ pF{{e}^{2+}}=2pH-13 \\\end{align}$ |
On trace le graphe $p{{M}^{2+}}=f\left( pH \right)$ .
On peut séparer
$B{{e}^{2+}}$ (fin de précipitation avant celle de $P{{b}^{2+}}$ ), et
$M{{g}^{2+}}$ (début de précipitation après la fin de précipitation de $F{{e}^{2+}}$ ).