L'orbitale moléculaire
Le recouvrement des niveaux atomiques (de la couche périphérique) 2 par 2 crée des niveaux “ liant “ et “ anti-liant “.
La somme des énergies des électrons isolés (états ${{\text{ }\!\!\Psi\!\!\text{ }}_{\text{A}}}\text{ }\!\!~\!\!\text{ et }\!\!~\!\!\text{ }{{\text{ }\!\!\Psi\!\!\text{ }}_{\text{B}}}$ ) est la même que celle des énergies des états liant et anti-liant (états ${{\text{ }\!\!\Psi\!\!\text{ }}_{\text{L}}}\text{ }\!\!~\!\!\text{ et }{{\text{ }\!\!\Psi\!\!\text{ }}_{\text{AL}}}$ ).
On peut représenter les différentes combinaisons possibles dans ce que l'on nomme le diagramme des orbitales moléculaires résultant du recouvrement des orbitales atomiques.
Les diagrammes présentés ci-dessous traitent du cas des molécules homonucléaires (les 2 atomes sont identiques) : ${{\text{F}}_{\text{2}}}\text{ }\!\!~\!\!\text{ , }{{\text{O}}_{\text{2}}}\text{ et }{{\text{N}}_{\text{2}}}$
L'ordre de liaison s'obtient en comptabilisant les doublets participant à l'orbitale moléculaire:
Ordre de liaison = Nombre de doublets liants - Nombre de doublets anti-liants.
Dans le cas de ${{\text{F}}_{\text{2}}}$ , l'ordre de liaison = 4-3 = 1 : il y a donc 1 doublet de liaison, la liaison est simple.
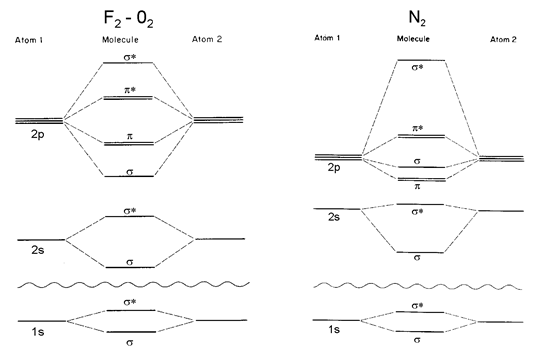
Une molécule qui ne comporte que des électrons appariés (en doublets) est dite diamagnétique (elle s'oriente dans le sens inverse du champ magnétique externe qu'on lui applique);
Si il y a des électrons non appariés (électrons célibataires), la molécule est paramagnétique (elle s'oriente dans le sens du champ magnétique externe qu'on lui applique).
Par exemple ${{\text{F}}_{\text{2}}}$ est diamagnétique alors que ${{\text{O}}_{\text{2}}}$ est paramagnétique (ainsi que NO).




