L'hybridation des orbitales atomiques
La molécule de méthane $\text{C}{{\text{H}}_{\text{4}}}$ est connue pour sa forme tétraédrique régulière (vérifiée par VSEPR), la règle de l'octet se trouvant bien respectée.
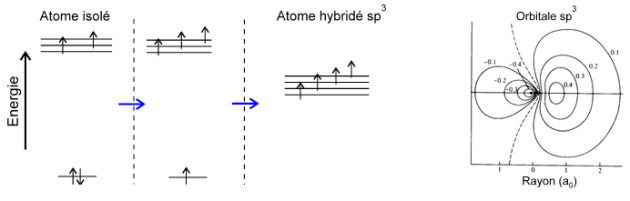
Cependant, l'angle de 109,5° et l'égalité des distances C-H ne sont pas compatibles avec les orbitales atomiques du carbone normalement disponibles (2s2, 2p4). Il y a alors formation de 4 orbitales hybrides équivalentes dont les fonctions d'onde résultent de la combinaison linéaire des orbitales atomiques par une expression de la forme:
$${{\Psi }_{Hybride}}={{c}_{1}}{{\Psi }_{2s}}+{{c}_{2}}{{\Psi }_{2{{p}_{x}}}}+{{c}_{3}}{{\Psi }_{2{{p}_{y}}}}+{{c}_{4}}{{\Psi }_{2{{p}_{z}}}}$$
On parlera alors d'hybridation $\text{s}{{\text{p}}^{\text{3}}}$ du carbone.
Les 4 orbitales hybrides $\text{s}{{\text{p}}^{\text{3}}}$ correspondent alors à des états d'énergie plus stables pour les électrons de valence comme le schéma de principe ci-dessous l'explique ; elles permettent 4 liaisons identiques à 109,5°.
Les cas les plus fréquents d'hybridation des orbitales atomiques correspondent aux formes géométriques déjà décrites dans la Méthode VSEPR :
Forme théorique | Angles des liaisons | Hybridation | Exemples |
|---|---|---|---|
Linéaire | 180° | $sp$ | $HC=CH~~~~~~~~~BeC{{l}_{2}}$ |
Triangulaire plane | 120° | $s{{p}^{2}}$ | $B{{F}_{3}}~~~~~~~~~~~~~~{{H}_{2}}C=C{{H}_{2}}$ |
Tétraédrique régulière | 109,5° | $s{{p}^{3}}$ | $C{{H}_{4}}~~~~~~~~~~~~~N{{F}_{3}}$ |
Bipyramide trigonale | 3x120° 2x90° | $s{{p}^{3}}d\text{ }~~(dp\text{ }+\text{ }s{{p}^{2}})~$ | $PC{{l}_{5}}~~~~~~~~~~~~S{{F}_{4}}$ |
Octaédrique régulière | 6x90° | $s{{p}^{3}}{{d}^{2}}$ | $S{{F}_{6}}~~~~~~~~~\text{ }~~~I{{F}_{5}}$ |




