Diagrammes logarithmiques de molarité (D.L.M.)
Le diagramme logarithmique de molarité s'obtient en traçant les courbes $log\text{ }{{\left[ c \right]}_{i}}=\text{ }f\left( pH \right)$ représentant la variation des concentrations en fonction du pH pour toutes les espèces présentes dans la solution.
Construction d'un D.L.M.
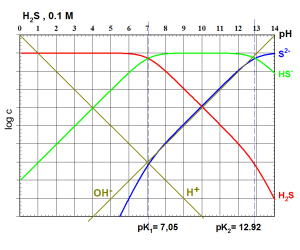
On choisit comme exemple un diacide ${{H}_{2}}A\text{ }(A.N.:\text{ }{{H}_{2}}S,\text{ }p{{K}_{1}}=7.05\text{ }et\text{ }p{{K}_{2}}=12.92,\text{ }{{c}_{0}}=0.1M)$ .
Espèces présentes : ${{H}_{3}}{{O}^{+}},\text{ }O{{H}^{-}},\text{ }{{H}_{2}}A,\text{ }~H{{A}^{-}},\text{ }{{A}^{2-}}$
Relations : $log\left[ {{H}_{3}}{{O}^{+}} \right]=-pH~~~~~~~~~~~~~~~~~log\left[ O{{H}^{-}} \right]=\text{ }pH-14$
$[{{A}^{2-}}]+[H{{A}^{-}}]+[{{H}_{2}}A]={{c}_{0}}$ que l'on peut écrire : $[{{A}^{2-}}]\left( 1+\frac{[{{H}_{3}}{{O}^{+}}]}{{{K}_{2}}}+\frac{{{[{{H}_{3}}{{O}^{+}}]}^{2}}}{{{K}_{1}}\cdot {{K}_{2}}} \right)={{c}_{0}}$
si on pose :
$$D=\left( 1+\frac{[{{H}_{3}}{{O}^{+}}]}{{{K}_{2}}}+\frac{{{[{{H}_{3}}{{O}^{+}}]}^{2}}}{{{K}_{1}}\cdot {{K}_{2}}} \right)$$
on obtient l'expression des valeurs des concentrations :
$$[{{A}^{2-}}]=\frac{{{c}_{0}}}{D}\,\,\,\,\,\,\,\,\,\,\,\,\,\,;\,\,\,\,\,\,\,\,\,\,\,[H{{A}^{-}}]=\frac{[{{H}_{3}}{{O}^{+}}]\cdot {{c}_{0}}}{{{K}_{2}}\cdot D}\,\,\,\,\,\,\,\,\,\,\,;\,\,\,\,\,\,\,\,\,[{{H}_{2}}A]=\frac{{{[{{H}_{3}}{{O}^{+}}]}^{2}}\cdot {{c}_{0}}}{{{K}_{1}}\cdot {{K}_{2}}\cdot D}$$
Il faut déterminer les valeurs possibles pour D dans les domaines de prédominance des 3 espèces ${{H}_{2}}A,\text{ }~H{{A}^{-}}et\text{ }{{A}^{2-}}$ :
$$\begin{align}& \otimes \,\ Si\,\,\,\,\,\,\,pH<p{{K}_{1}}\,\,\,:\,\,\,\,\,{{H}_{2}}A\,\,\,\,est\,\,l'esp\grave{e}ce\,\,majoritaire\,\,: \\& \,\,\,\,\,\,[{{H}_{2}}A]\approx \,{{c}_{0}}\,\,et\,\,D\approx \frac{{{[{{H}_{3}}{{O}^{+}}]}^{2}}}{{{K}_{1}}\cdot {{K}_{2}}}\,\,\,\,\,alors\,\,\,\,\,\,\,\,;\,\,\,\,\,\,\,\,\,\,\,[H{{A}^{-}}]=\frac{{{K}_{1}}\cdot {{c}_{0}}}{[{{H}_{3}}{{O}^{+}}]}\,\,\,\,\,\,\,\,\,\,\,;\,\,\,\,\,\,\,[{{A}^{2-}}]=\frac{{{c}_{0}}\cdot {{K}_{1}}\cdot {{K}_{2}}}{{{[{{H}_{3}}{{O}^{+}}]}^{2}}} \\& \,\,\,\,\,\,d'o\grave{u}\,\,\,\,\,\log [{{H}_{2}}A]=\log {{c}_{0}}\,\,\,\,\,\,\,\,\,\,\,\,\,;\,\,\,\,\,\,\,\,\,\,\log \,[H{{A}^{-}}]=pH-p{{K}_{1}}+\log {{c}_{0}}\,\,\,\,\,\,\,\,\,;\,\,\,\,\,\,\,\,\,\,\log [{{A}^{2-}}]=2pH-p{{K}_{1}}-p{{K}_{2}}+\log {{c}_{0}} \\\end{align}$$
$$\begin{align}& \otimes \ \,Si\,\,\,\,\,\,\,\,p{{K}_{1}}<pH<p{{K}_{2}}\,\,\,:\,\,\,\,\,H{{A}^{-}}\,\,\,\,est\,\,l'esp\grave{e}ce\,\,majoritaire\,\,: \\& \,\,\,\,\,\,[H{{A}^{-}}]\approx \,{{c}_{0}}\,\,et\,\,D\approx \frac{[{{H}_{3}}{{O}^{+}}]}{{{K}_{2}}}\,\,\,\,\,alors\,\,\,\,\,\,\,\,;\,\,\,\,\,\,\,\,\,\,\,[{{H}_{2}}A]=\frac{[{{H}_{3}}{{O}^{+}}]\cdot {{c}_{0}}}{{{K}_{1}}}\,\,\,\,\,\,\,\,\,\,\,;\,\,\,\,\,\,\,[{{A}^{2-}}]=\frac{{{c}_{0}}\cdot {{K}_{2}}}{[{{H}_{3}}{{O}^{+}}]} \\& \,\,\,\,\,\,d'o\grave{u}\,\,\,\,\,\log [{{H}_{2}}A]=-pH+p{{K}_{1}}+\log {{c}_{0}}\,\,\,\,\,\,\,\,\,\,\,\,\,;\,\,\,\,\,\,\,\,\,\,\log \,[H{{A}^{-}}]=\log {{c}_{0}}\,\,\,\,\,\,\,\,\,;\,\,\,\,\,\,\,\,\,\,\log [{{A}^{2-}}]=pH-p{{K}_{2}}+\log {{c}_{0}} \\\end{align}$$
$$\begin{align}& \otimes \,\ Si\,\,\,\,\,\,\,\,p{{K}_{2}}<pH\,\,\,:\,\,\,\,\,{{A}^{2-}}\,\,\,\,est\,\,l'esp\grave{e}ce\,\,majoritaire\,\,: \\& \,\,\,\,\,\,[{{A}^{2-}}]\approx \,{{c}_{0}}\,\,et\,\,D\approx 1\,\,\,\,\,alors\,\,\,\,\,\,\,\,;\,\,\,\,\,\,\,\,\,\,\,[H{{A}^{-}}]=\frac{[{{H}_{3}}{{O}^{+}}]\cdot {{c}_{0}}}{{{K}_{2}}}\,\,\,\,\,\,\,\,\,\,\,;\,\,\,\,\,\,\,[{{H}_{2}}A]=\frac{{{[{{H}_{3}}{{O}^{+}}]}^{2}}\cdot {{c}_{0}}}{{{K}_{1}}\cdot {{K}_{2}}} \\& \,\,\,\,\,\,d'o\grave{u}\,\,\,\,\,\log [{{H}_{2}}A]=-2pH+p{{K}_{1}}+p{{K}_{2}}+\log {{c}_{0}}\,\,\,\,\,\,\,\,\,\,\,\,\,;\,\,\,\,\,\,\,\,\,\,\log \,[H{{A}^{-}}]=-pH+p{{K}_{2}}+\log {{c}_{0}}\,\,\,\,\,\,\,\,\,;\,\,\,\,\,\,\,\,\,\,\log [{{A}^{2-}}]=\log {{c}_{0}} \\\end{align}$$
Points singuliers :
$$\begin{align}& \otimes \,\ Si\,\,\,\,\,\,\,pH=p{{K}_{1}}\,\,\,:\,\,\,\,\,H{{A}^{-}}\,\,et\,\,\,[{{H}_{2}}A]\,\,\,\,sont\,\,\,\,majoritaires\,\,:\,\,\,\,\,\,\,\,\,[{{H}_{2}}A]=[H{{A}^{-}}]={}^{{{c}_{0}}}/{}_{2} \\& \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,d'o\grave{u}\,\,\,\,\,\log [{{H}_{2}}A]=\,\log \,[H{{A}^{-}}]=\log {{c}_{0}}-0.3 \\& \otimes \,\ Si\,\,\,\,\,\,\,pH=p{{K}_{2}}\,\,\,:\,\,\,\,\,H{{A}^{-}}\,\,et\,\,\,[{{A}^{2-}}]\,\,\,\,sont\,\,\,\,majoritaires\,\,:\,\,\,\,\,\,\,\,\,[H{{A}^{-}}]=[{{A}^{2-}}]={}^{{{c}_{0}}}/{}_{2} \\& \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,d'o\grave{u}\,\,\,\,\,\,\log \,[H{{A}^{-}}]=\log [{{A}^{2-}}]=\log {{c}_{0}}-0.3 \\\end{align}$$
Remarques :
|
Applications et exemples
pH d'une solution d'acide faible : ${{H}_{2}}S,\text{ }p{{K}_{1}}=7.05,\text{ }p{{K}_{2}}=12.92,\text{ }{{c}_{0}}=0.1M$
On lit graphiquement pH=4 après avoir tracé $log\left[ {{H}_{3}}{{O}^{+}} \right]$ à l'origine fixée par la valeur choisie pour ${{c}_{0}}$. |
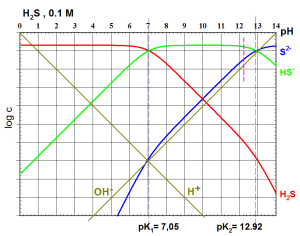
pH d'une solution de sel(s) : - La dissociation du sel est totale - $NaHS\to N{{a}^{+}}+H{{S}^{-}}$
Relation d'électroneutralité : $[{{H}_{3}}{{O}^{+}}]+[N{{a}^{+}}]=2\cdot [{{S}^{2-}}]+[H{{S}^{-}}]+[O{{H}^{-}}]$ {1}
Relation de conservation des espèces : $[N{{a}^{+}}]=[{{S}^{2-}}]+[H{{S}^{-}}]+[{{H}_{2}}S]={{c}_{0}}=0.1$ {2}
{1}-{2}={3} $[{{H}_{3}}{{O}^{+}}]=[{{S}^{2-}}]+[O{{H}^{-}}]-[{{H}_{2}}S]$ {3}
HS- est l'espèce prédominante (elle évoluera peu car l'acide est faible) : donc 7.05<pH<12.92 .
Dans ce domaine de pH :
$$\left[ {{H}_{2}}S \right]<<\text{ }\left[ {{H}_{3}}{{O}^{+}} \right]\text{ }~~~~~~~et~~~~~~~~~~\left[ O{{H}^{-}} \right]<\text{ }\left[ {{S}^{2-}} \right]$$
il reste : $\left[ {{H}_{2}}S \right]=\left[ {{S}^{2-}} \right]$
On trouve pH=9.8
Un traitement plus rigoureux ne tenant pas compte de la 2ème approximation $(\left[ O{{H}^{-}} \right]<\text{ }\left[ {{S}^{2-}} \right])$ donne pH=9.85
pH d'un mélange d'acide et de base :
$20mL\text{ }de\text{ }NaOH\text{ }0,25M,\text{ }30\text{ }mL\text{ }de\text{ }N{{a}_{2}}S{{0}_{3}}\text{ }0,33M,\text{ }50mL\text{ }de\text{ }{{H}_{2}}S\text{ }0,2M$
Les concentrations sont au départ :
$$\left[ N{{a}^{+}} \right]=\text{ }0,25\text{ }M\text{, }~~\left[ {{H}_{2}}S \right]=\text{ }0,1\text{ }M,~\text{ }\left[ {{S}^{2-}} \right]=\text{ }0,1\text{ }M\text{, }~\left[ O{{H}^{-}} \right]=0,05\text{ }M$$
réaction de neutralisation (base plus forte avec acide plus fort) :
$$NaOH\text{ }+\text{ }{{H}_{2}}S\to N{{a}^{+}}+\text{ }H{{S}^{-}}+\text{ }{{H}_{2}}O$$
on a alors une solution de concentration :
$$\left[ N{{a}^{+}} \right]=\text{ }0,25\text{ }M,\text{ }\left[ {{H}_{2}}S \right]=\text{ }0,05\text{ }M,\text{ }\left[ H{{S}^{-}} \right]=\text{ }0,05M~\text{, }\left[ {{S}^{2-}} \right]=\text{ }0,1\text{ }M$$
puis
$${{H}_{2}}S+\text{ }{{S}^{2-}}\to 2\text{ }H{{S}^{-}}\text{ }~\left( K={{10}^{5,92}}>>1 \right)$$
d'où
$$\left[ H{{S}^{-}} \right]=\text{ }0,15\text{ }M~\text{ }~\left[ {{S}^{2-}} \right]=\text{ }0,05\text{ }M$$
${{S}^{2-}}$ est une base relativement forte : (on voit bien sur le DLM que $O{{H}^{-}}$ n'est pas négligeable )
il faut considérer l'équilibre :
$${{S}^{2-}}+\text{ }{{H}_{2}}O\rightleftarrows H{{S}^{-}}+\text{ }O{{H}^{-}}~~~~{{K}_{b2}}=\text{ }{{10}^{-14+pka2}}=\text{ }{{10}^{-1,08}}$$
soit ${{K}_{b2}}=\frac{\left[ O{{H}^{-}} \right]\left[ H{{S}^{-}} \right]}{\left[ {{S}^{2-}} \right]}$
avec $\left[ H{{S}^{-}} \right]+\left[ {{S}^{2-}} \right]=0,2\text{ }M$ (on néglige ${{H}_{2}}S$)
et $\left[ N{{a}^{+}} \right]=\left[ O{{H}^{-}} \right]+\left[ H{{S}^{-}} \right]+2\left[ {{S}^{2-}} \right]$ (on néglige ${{H}_{3}}{{O}^{+}}$)
on trouve une équation du 2ème degré $\left[ O{{H}^{-}} \right]=0,017 M $ soit pH=12,2