Etude expérimentale
Elle s'effectue à partir de la représentation graphique d'une variable $\xi $ , ou $\tau $ (taux d'avancement) en fonction du temps.
Méthodes chimiques
Une méthode est qualifiée de chimique quand la détermination de la concentration repose sur une réaction chimique de dosage.
On prélève des échantillons dans le milieu réactionnel à différents instants ; on « gèle » le système dans son état par trempe (dilution ou brusque refroidissement) et on dose.
Inconvénients :
des quantités importantes de réactifs sont nécessaires ;
il faut disposer d'une réaction de dosage auquel participe un des réactifs,
la réaction de dosage doit être rapide par rapport à la réaction étudiée ;
les mesures se font de manière discontinue.
C'est une méthode destructive.
Méthodes physiques
La concentration de l'espèce étudiée est déterminée à partir de la mesure d'une grandeur physique.
Ce peut être par mesure d'un volume de gaz dégagé, mesure de pH, mesure de conductance, mesure d'absorbance, mesure de pression...(possiblité d'enregistrer directement le graphique avec des appareils automatisés).
Avantages :
mesures en continu,
nécessitent que de faibles quantités de réactifs,
ne perturbent pas généralement le système réactionnel,
très grande sensibilité des appareils ce qui permet de faibles concentrations de réactifs...
Obtention de la vitesse
On obtient la vitesse volumique de formation à chaque instant à partir du coefficient directeur de la tangente à la courbe à cet instant. Le coefficient directeur de la tangente à la courbe rouge représentative de $\text{ }\!\![\!\!\text{ A }\!\!]\!\!\text{ (t)=f(t)}$ au point M d'abscisse ${{\text{t}}_{\text{1}}}$ donne la vitesse de la réaction à un instant donné. | 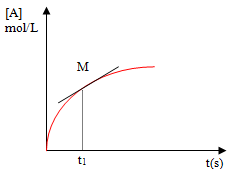 |
Détermination des ordres partiels
Utilisation de mélanges stœchiométriques
Soit A + B = produits , si ${{[A]}_{0}}={{[B]}_{0}}$ alors à tout instant, ${{[A]}_{t}}={{[B]}_{t}}$
$$V=k{{[A]}^{p}}.{{[B]}^{q}}=k{{[A]}^{p+q}}$$
Ceci permet la détermination de l'ordre global p+q.
Dégénérescence de l'ordre
Si le mélange initial contient un excès du réactif A par rapport au réactif B
la concentration de A au cours du temps est pratiquement constante
$V=k.{{[A]}^{p}}.{{[B]}^{q}}=k'.{{[B]}^{q}}$ avec k' constante de vitesse apparente $=\text{ }k.{{\left[ A \right]}^{p}}$
on peut alors déterminer q. On dit qu'il y a dégénérescence de l'ordre par rapport au réactif en excès.
Détermination de l'ordre
à partir des temps de demi-réaction
L'expression du temps de demi-réaction est une caractéristique de l'ordre de la réaction et permet de déterminer son ordre.
par méthode différentielle
Si la réaction admet un ordre, on doit avoir $V=k.{{[A]}^{p}}$; la courbe représentant $\text{LnV}$ en fonction de $\text{Ln}\left[ \text{A} \right]$ est une droite de pente p
par méthode intégrale
Dans cette méthode, on fait une hypothèse sur l'ordre de la réaction. On intègre l'équation différentielle obtenue $d[A]/dt=k.{{[A]}^{p}}$.
On détermine ainsi une fonction linéaire que l'on trace en fonction du temps. Si l'on obtient une droite, l'hypothèse est vérifiée.
par la méthode des vitesses initiales
On réalise une série d'expériences à la même température ; pour chacune d'elles, on étudie l'évolution de A à partir d'une concentration initiale [A]0 connue. On en déduit la vitesse initiale V0 en déterminant la pente de la tangente à l'origine à la courbe $\left[ A \right]\text{ }=\text{ }f\left( t \right)$ .
Or ${{V}_{0}}=k.[A]_{0}^{p}\ \ \Rightarrow Ln\ {{V}_{0}}=Ln\ k+p.Ln\ {{[A]}_{0}}$ droite de pente $\text{k}$ et d'ordonnée à l'origine $\text{Lnk}$.
Cette méthode permet de déterminer l'ordre initial mais pas l'ordre courant d'une réaction.
L'étude des mécanismes réactionnels faisant intervenir des réactions consécutives sera vue en deuxième année.




