La pile électrochimique, le potentiel redox
Une pile électrochimique est constituée par 2 demi-piles (2 couples redox) reliées par un pont ionique ou une membrane (permettant la circulation des ions).
On mesure une force électromotrice ($fem={{E}_{1-2}}$ ) aux bornes de la pile. On convient de représenter la chaîne d'électrolytes constituant la pile en disposant à gauche le pôle - et à droite le pôle +.
Une pile décrite par la séquence: $-Zn\left| Z{{n}^{2+}} \right.\left| KCl\left| C{{u}^{2+}}\left| Cu\ \oplus \right. \right. \right.$ ou $-\left. Zn \right|\left. Z{{n}^{2+}} \right\|\left. C{{u}^{2+}} \right|Cu\ \oplus $ correspond à la demi-pile $Z{{n}^{2+}}/Zn$ associée à la demi-pile $C{{u}^{2+}}/Cu$ par l'intermédiaire d'un pont ionique de KCl.
Simulation :
L'équation de Nernst
Dans les conditions standard (25°C, P=1atm = TPN), l' enthalpie libre d'un système (état initial - état final) s'écrit :
$\Delta {{G}^{0}}=\Delta {{H}^{0}}-T\Delta {{S}^{0}}$ avec $\Delta {{G}^{0}}$ Enthalpie (ou énergie) libre, $\Delta {{H}^{0}}$Enthalpie, $\Delta {{S}^{0}}$ Entropie et T la température.
D'autre part : $\Delta {{G}^{0}}=-RT\log K=-nF{{E}^{0}}$.
Pour une réaction électrochimique, on écrit :
$$\begin{align}& \oplus \ \ Pour\ \ \ o{{x}_{1}}+re{{d}_{2}}\rightleftarrows re{{d}_{1}}+o{{x}_{2}}\ \ \ avec\ Q=\frac{\left[ re{{d}_{1}} \right]\cdot \left[ o{{x}_{2}} \right]}{\left[ o{{x}_{1}} \right]\cdot \left[ re{{d}_{2}} \right]}\ \ \ et\ \ si\ \ E\ \ \ est\ la\ fem\ de\ la\ pile \\& \ \ \ \ \ \ \ \ \ \ \ \ \ \ \Delta G=-n\cdot F\cdot E=\Delta {{G}^{0}}+RT\cdot Log\ Q=-n\cdot F\cdot {{E}^{0}}+RT\cdot Log\frac{\left[ re{{d}_{1}} \right]\cdot \left[ o{{x}_{2}} \right]}{\left[ o{{x}_{1}} \right]\cdot \left[ re{{d}_{2}} \right]} \\& \ \ \ \ \ \ \ \ \ \ \ \ \ \ on\ obtient\ \ \ \ \ \ \ \ \ E={{E}^{0}}+\frac{RT}{nF}\cdot Log\frac{\left[ o{{x}_{1}} \right]\cdot \left[ re{{d}_{2}} \right]}{\left[ re{{d}_{1}} \right]\cdot \left[ o{{x}_{2}} \right]} \\& \oplus \ \ Pour\ une\ demi\ r\acute{e}action:\ \ \ \ \ \ \ \ o{{x}_{1}}+n{{e}^{-}}\rightleftarrows re{{d}_{1}} \\& \ \ \ \ \ \ \ \ \ \ \ \ \ \ E={{E}^{0}}+\frac{RT}{nF}\cdot Log\frac{\left[ o{{x}_{1}} \right]}{\left[ re{{d}_{1}} \right]}={{E}^{0}}+\frac{0.059}{n}\cdot \log \frac{\left[ o{{x}_{1}} \right]}{\left[ re{{d}_{1}} \right]}\ \ \ \ \ \ \ \ \ Equation\ de\ NERNST \\\end{align}$$
La pile DANIELL
Elle est formée par les couples $Cu/C{{u}^{2+}}~et\text{ }Zn/Z{{n}^{2+}}~$ (l'électrode du métal plonge dans une solution d'un de ses sels). On mesure une fem de 1.1 Volt dans les conditions standard (25°C) si les concentrations des ions $Cu/C{{u}^{2+}}~et\text{ }Zn/Z{{n}^{2+}}~$ sont égales (mélange équimoléculaire). On constate que l'électrode de zinc est attaquée (dissolution) et que du cuivre se dépose sur l'électrode de cuivre (augmentation de sa masse), ce qui correspond aux demi-réactions et au bilan réactionnel suivants : $$\begin{align}& Pole\ \ +\ \ \ \ :\ \ \ \ \ \ \ C{{u}^{2+}}+2{{e}^{-}}\rightleftarrows Cu \\& Pole\ \ -\ \ \ \ :\ \ \ \ \underline{\ \ \ \ \ \ \ \ \ \ \ \ \ Zn\rightleftarrows Z{{n}^{2+}}+2{{e}^{-}}} \\& Bilan\ \ \ \ \ \ \ :\ \ \ \ \ \ \ \ C{{u}^{2+}}+\ Zn\rightleftarrows Cu+Z{{n}^{2+}} \\\end{align}$$ | 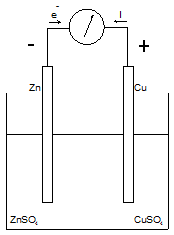 |
La pile débite jusqu'à disparition de l'électrode de zinc, mais son potentiel varie car la concentration des ions évolue.
Echelle des potentiels standards ${{E}^{0}}$
On choisit comme référence l'électrode à hydrogène normale formée par une électrode de platine plongeant dans une solution normale d'ions H+ balayée par de l'hydrogène gazeux sous une pression de 1 atmosphère ([H+]=1M, pH2=1atm): $${{H}^{+}}+{{e}^{-}}\rightleftarrows {\scriptstyle{}^{1}/{}_{2}}{{H}_{2\ \ \ \ \ \ }}\ \ E_{{{H}^{+}}/{{H}_{2}}}^{0}=0.0\ Volt$$ Le potentiel standard ${{E}^{0}}$ d'un couple redox est le potentiel de la chaîne électrochimique constituée par la demi-pile formée par la solution de concentration unitaire ([Ox]=[Red] ) et la demi-pile ${{H}^{+}}/{{H}_{2}}~$ (c'est donc la fem de cette pile) : | 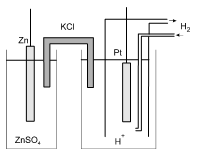 |
Les tables rassemblent les valeurs des potentiels standards; le signe du potentiel est celui pris par l'électrode dans la pile réalisée avec l'électrode à hydrogène.




