Structures des Solides simples inorganiques (2) par
Dr
S.J. Heyes
Traduction et adaptation (ajoût des modèles
dynamiques): Pr C. Jacoboni - Université du
Maine
Lecture 2. Description des structures 'ioniques'
simples.
1. Ions et structures ioniques
2. 'Structures ioniques' dérivant de l'occupation
de sites intersticiels dans les empilements compacts
3. Structures décrites à partir de polyèdres
connectés
4. Description de quelques structures très connues
Des structures 'ioniques ou non' peuvent
dériver
de l'occupation de sites intersticiels dans les empilements
compacts
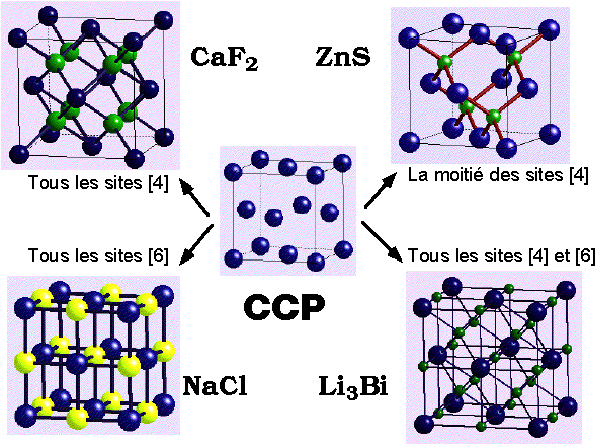
Quelques structures binaires
dérivant du remplissage des sites
dans les empilements cubique faces centrées (CCP) et hexagonal compact (HCP)
| Formule |
Type et fraction des sites occupés |
CCP |
HCP |
| AB |
Tous les sites octaédriques |
NaCl Chlorure
de sodium |
NiAs Arseniure de Nickel |
| La moitié des sites tétraédriques |
ZnS Blende
(Sphalerite) |
ZnS Wurtzite |
|
AB2
|
Tous les sites tétraédriques |
Na2O Anti-Fluorine
CaF2 Fluorine
|
inconnu
|
| AB3 |
Tous les sites octaédriques
& tétraédriques |
Li3Bi |
inconnu |
| A2B |
La moitié des sites octaédriques
(couches alternativement remplies ou vides) |
CdCl2
Chlorure de Cadmium |
CdI2 Iodure
de Cadmium |
La moitié des sites octaédriques
(arrangement ordonné) |
TiO2 Anatase |
TiO2 Rutile |
| A3B |
Le tiers des sites octaédriques
Couches alternées 2/3 pleines/vides |
CrCl3 Trichlorure de chrome |
BiI3 Triiodure de bismuth |
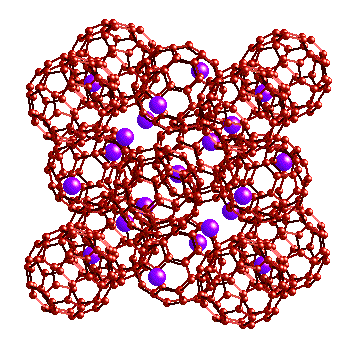
Le remplissage des sites ne se produit pas seulement
avec des atomes.
Les molécules C60 sont disposées en un arrangement
cubique faces centrées. Si C60 est réduit par du potassium, il forme
des composés comme K3C60 dans lequel l'ensemble C603-
forme un réseau cfc dans lequel les ions K+ occupent tous les ites
octaédriques et tétraédriques.
Représentations polyédriques
En définissant l'environnement de coordination
comme un polyèdre
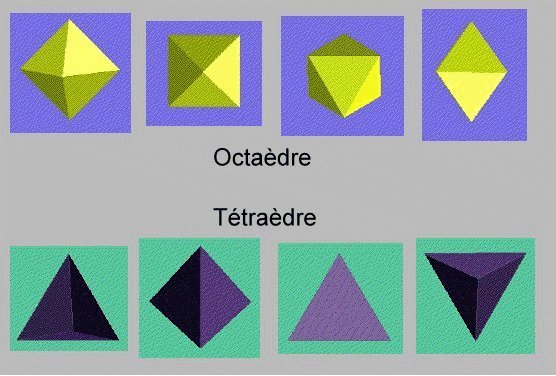
La représentation polyédrique des structures s'obtient
en reliant les polyèdres de coordination entre eux
Structures dérivant
De l'empilement Cubique Faces Centrées (CCP)
NaCl Rock
Salt (Chlorure de sodium)
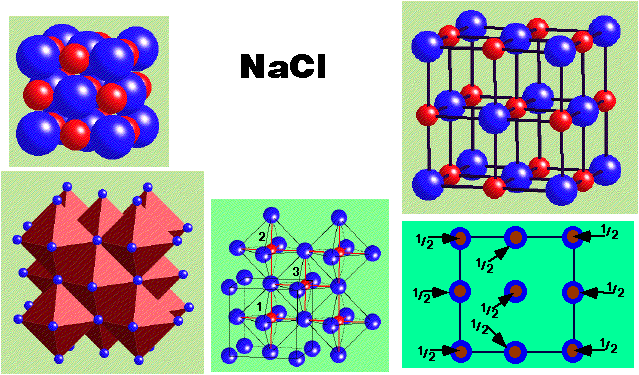 |
Description de la structure
- Cl- (CCP) avec Na+ dans tous les sites
octaédriques
- Réseau:F
- Motif: Cl en (0,0,0); Na en (1/2,0,0)
- 4 NaCl dans la maille
- Coordination: 6:6 (octaédrique)
- Les sites des cations et des anions sont topologiquement identiques
|
Composés de type NaCl
- Très communs (inc. 'ioniques', 'covalents' & 'intermetalliques'
)
- La plupart des halogénures alcalins
(CsCl, CsBr, CsI exceptés)
- Beaucoup d'oxydes / sulfures des alcalino-terreux
- Nombreux nitrures, phosphures, hydrures (e.g. ZrN,TiC, NaH)
|
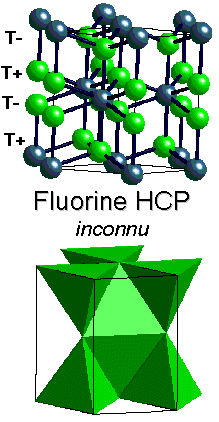
CaF2
Fluorine / {Na2O Anti-Fluorine}
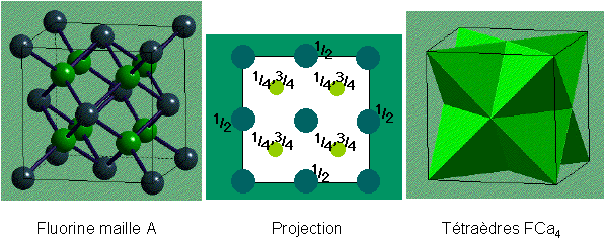
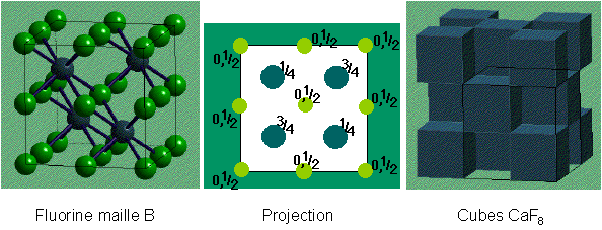 |
Description de la structure
- Ca2+ (CCP) avec F- dans tous les sites
tétraédriques
- Réseau: cfc
- Motif: Ca2+ à (0,0,0);
2F- à (1/4,1/4,1/4) & (3/4,3/4,3/4)
- 4 CaF2 par maille
- Coordination: Ca2+: 8 (cubique)
F-: 4 (tétraédrique)
- Dans la structure Anti-fluorine, les positions des cations et des
anions sont inversées
|
Composés de type CaF2
- Fluorures des gros cations divalents, chlorures de Sr, Ba
- Oxydes des gros cations tétravalents (Zr, Hf,Ce, Th, U)
Composés de type Na2O
- Oxydes /chalgogénures des métaux alcalins
|
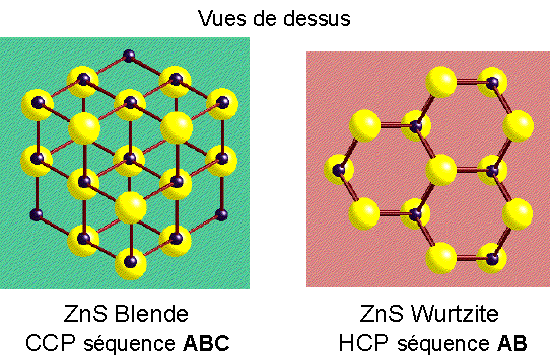
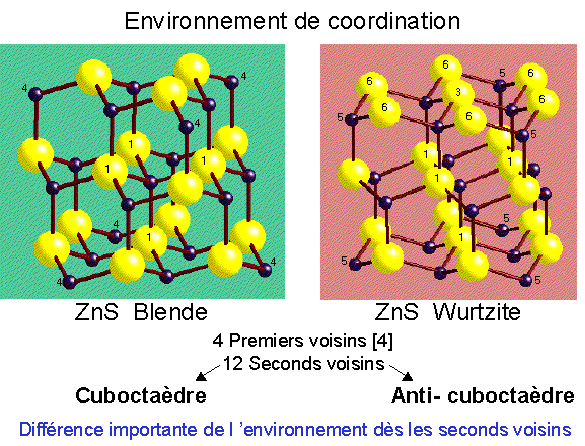
ZnS Blende
(Sphalerite)
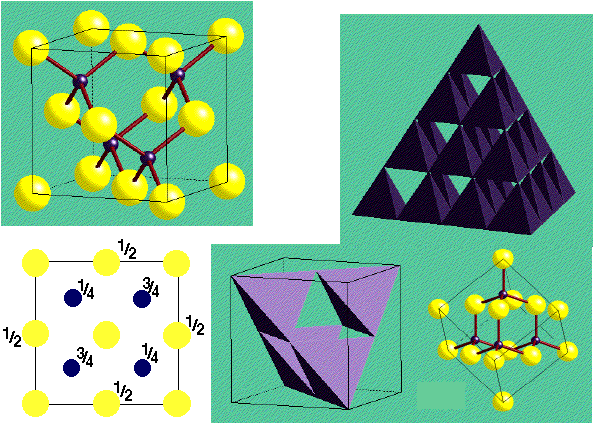
|
Description de la structure
- S2- (CCP) avec Zn2+ dans la moitié
des sites tétraédriques (seulement les sites T+ sont remplis)
- Réseau: cfc
- 4 ZnS par maille
- Motif: S à (0,0,0); Zn à (1/4,1/4,1/4)
- Coordination: 4:4 (tétraédrique)
- Les sites cationiques et anioniques sont topologiquement identiques
|
Composés de type ZnS (Blende)
- Formés à partir de cations polarisants (Cu+, Ag+,
Cd2+, ...)
et d'anions polarisables
(I-, S2-, P3-, ...);
e.g. Cu(F,Cl,Br,I), AgI, Zn(S,Se,Te), Ga(P,As), Hg(S,Se,Te)
|
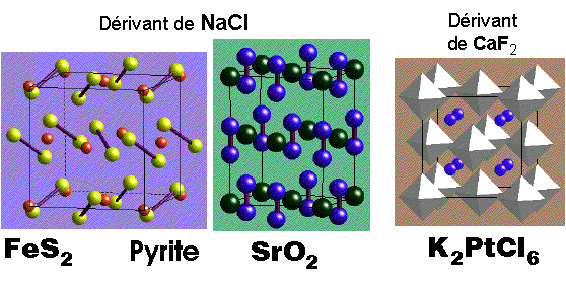
Structures dérivant des types NaCl et CaF2
Structures dérivant de l'empilement hexagonal compact
(hcp)
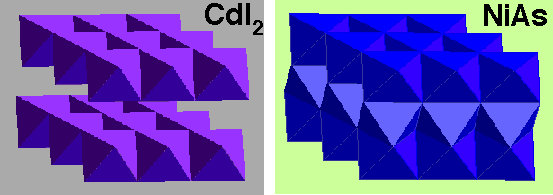
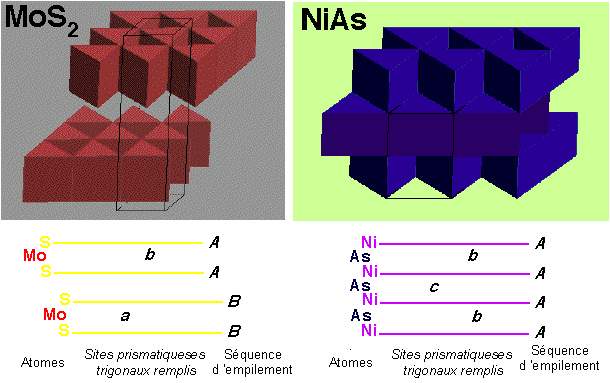
NiAs - Arseniure de nickel
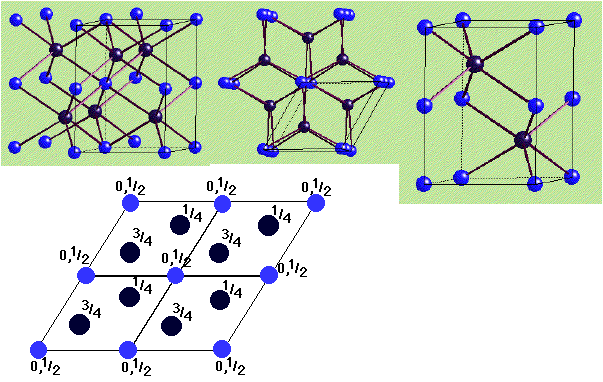
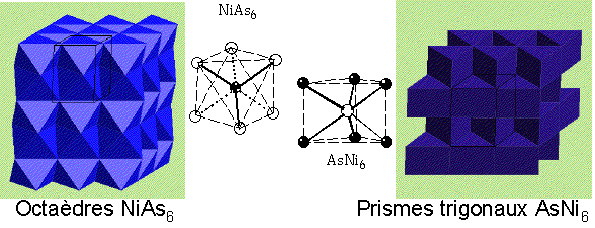 |
Description de la structure
- As (HCP) avec Ni dans tous les sites octaédriques
- Réseau: Hexagonal - P
- a = b, c =sqrt(8/3)a
- Motif:
2Ni à (0,0,0) & (0,0,1/2)
2As à (2/3,1/3,1/4) & (1/3,2/3,3/4)
- 2 NiAs par maille
- Coordination:
Ni: 6 (octaédrique)
As: 6 (prisme trigonal)
|
Composés de type NiAs
- Métaux de transition avec des chalcogènes, As, Sb, Bi
e.g. Ti(S,Se,Te); Cr(S,Se,Te,Sb); Ni(S,Se,Te,As,Sb,Sn)
|
ZnS Wurtzite
|
Description de la structure
- S (HCP) aves Zn dans la moitié des sites tétraédriques
- Réseau: Hexagonal - P
- a = b, c Å Ã(8/3)a
- Motif:
2S à (0,0,0) & (2/3,1/3,1/2);
2Zn à (2/3,1/3,1/8) & (0,0,5/8)
- 2 ZnS par maille
- Coordination: 4:4 (tétraédrique)
|
Comparaison de la Wurtzite et de la Blende
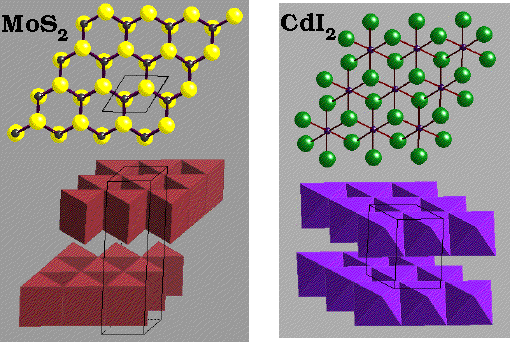
CdI2
Iodure de Cadmium
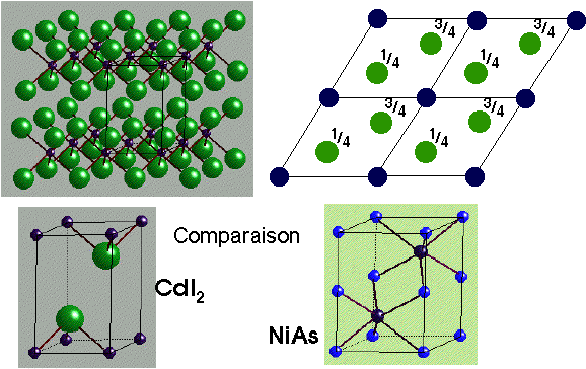
|
Description de la structure
- I (HCP) avec Cd dans des couches alternées de sites octaédriques
- Réseau: Hexagonal - P
- Motif:
Cd à (0,0,0)
2I à (2/3,1/3,1/4) & (1/3,2/3,3/4)
- 1 CdI2 par maille
- Coordination:
Cd: 6 (octaédrique)
I: 3 (pyramide triangulaire)
|
Composés de type CdI2
- Iodures des cations modéremment polarisants ; bromures et chlorures
de cations fortement polarisants;
e.g. PbI2, FeBr2, VCl2
- Hydroxydes de nombreux cations divalents
e.g. (Mg,Ni)(OH)2
- Di-chalcogénures de nombreux cations tétravalents
e.g. TiS2, ZrSe2, CoTe2
|
STRUCTURES NON COMPACTES
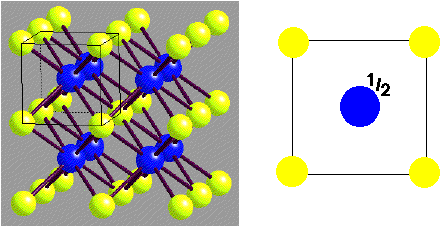
CsCl
- Chlorure de Cesium
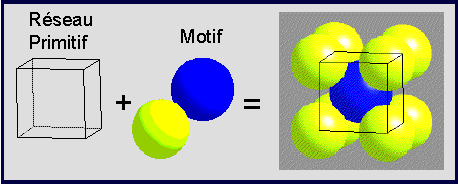 |
Description de la structure
- Réseau: Cubique - P (N.B. Primitive!)
- Motif: Cl à (0,0,0); Cs à (1/2,1/2,1/2)
- 1 CsCl par maille
- Coordination: 8:8 (cubique)
|
Composés de type CsCl
- Chlorures, bromures et iodures des cations les plus gros
e.g. Cs+, Tl+, NH4+
|
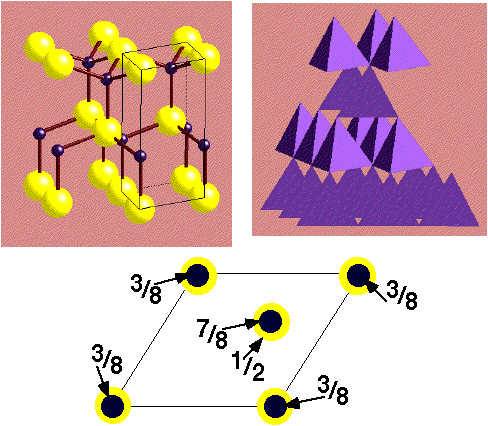
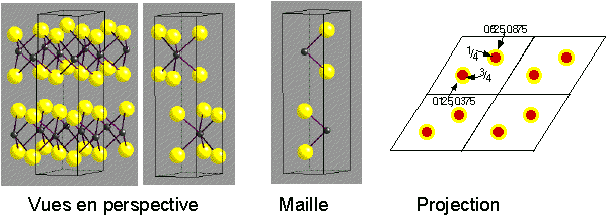
MoS2 - Molybdenite
|
Description de la structure
- Note:Les couches hexagonales d'atomes de S ne sont pas
compactes
- Réseau: Hexagonal - P
- Motif:
2Mo à (2/3,1/3,3/4) & (1/3,2/3,1/4)
4S à (2/3,1/3,1/8), (2/3,1/3,3/8), (1/3,2/3,5/8) & (1/3,2/3,7/8)
- 2 MoS2 par maille
- Coordination:
Mo: 6 (Prisme trigonal)
S: 3 (pyramide triangulaire)
|
Comparaison
de MoS2 et CdI 2
 |
CdCl2
- Chlorure de cadmium
- Chlorures des cations modéremment polarisants
e.g. MgCl2, MnCl2
- Di-sulfures des cations tétravalents e.g.
TaS2,NbS2 (aussi une forme CdI2)
- Cs2O a la structure anti-chlorure de cadmium

© S.J.Heyes,
Oxford, 1996
Traduction -Adaptation (ajoût des modèles dynamiques): Pr
C. Jacoboni, Université du Maine, 1998
Dernière mise à jour :
14/07/02