| |
 |
|
| |
 |
|
Structures des Solides simples inorganiques
(3) par Dr
S.J. Heyes
Traduction et adaptation :
Pr C. Jacoboni - Université du Maine
3. Des intéractions spécifiques stabilisant des structures (e.g. NiAs, PbO, PdO, NH4F)
4. Liaison dirigée/Covalence/Polarisation - tendance en dimensionnalité
Principes de Laves
Considérer un solide comme ionique - Quel intérêt?
Suivant l'avis de D.M. Adams : "La théorie ionique est un bon point de départ pour se faire une idée générale ....La théorie ionique a fait du chemin (> 50 ans) et est encore fortement supportée: Dès que des considérations précises des structures cristallines sont concernées, il est temps alors de l'enterrer"
Le 'modèle ionique' (Goldschmidt)
"Les ions sont des sphères essentiellement chargées, incompressibles et non-polarisables"
(Des modèles plus élaborés considèrent que les ions sont composés de 2 parties :- un noyau central dur où la majeure partie de la densité électronique est concentrée, & une sphère exterieure molle et polarisable qui contient une légère densité électronique )
Les règles de Pauling
Règle de Pauling n°1: Polyèdres de coordination

Matériaux moléculaires
e.g. NaICl, MgIIO, ScIIIN, TiIVC ont tous la structure NaCl en dépit de l'évolution de la valence et du caractère iono-covalent des liaisons
Le nombre de coordination d'un cation sera le plus élevé possible pour respecter le critère de contact Cation-Anion.
Déterminé par le rapport des rayons ioniques, r+/r- dont les valeurs sont dérivées des critères géométriques de contact,
Les Règles de rayon ionique
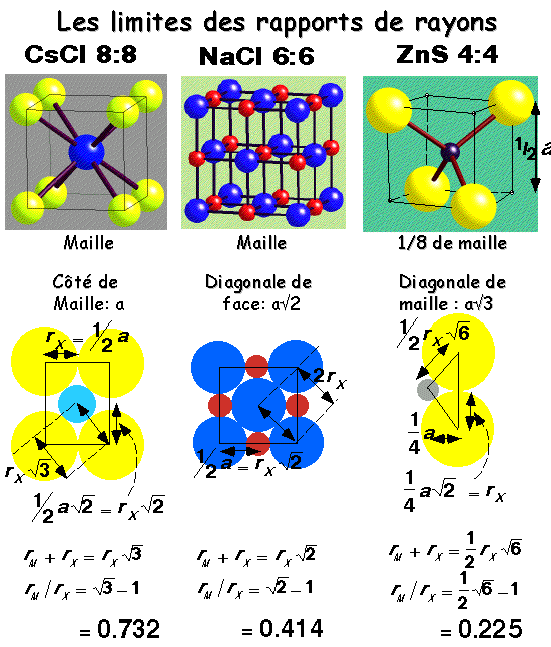
| Rapport des rayons | Nbre de coordination | Structure-type Binaire (AB) |
| r+/r- = 1 | 12 | inconnu |
| 1 > r+/r- > 0.732 | 8 | CsCl |
| 0.732 > r+/r- > 0.414 | 6 | NaCl |
| 0.414 > r+/r- > 0.225 | 4 | ZnS |
Quelle est la valeur numérique d'un rayon ionique donné?
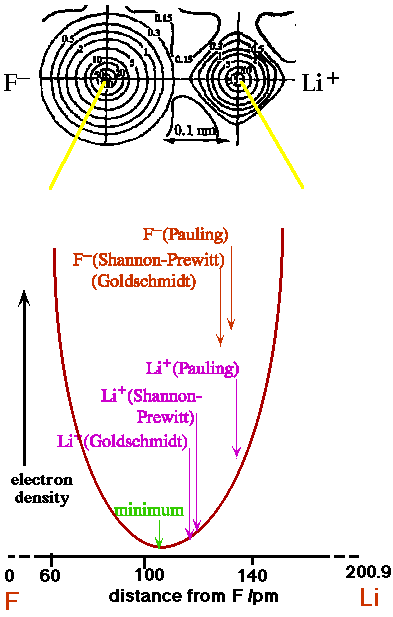
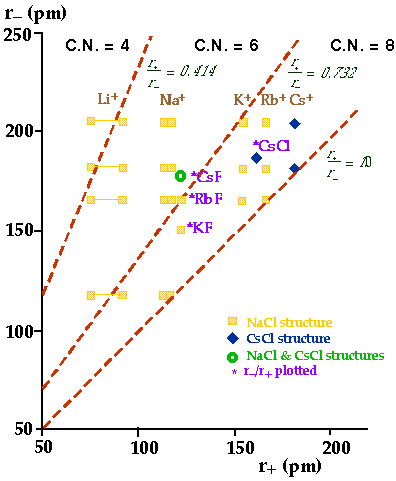
Est-ce que les règles du rapport des rayons ioniques fonctionnent?
Vérifiez avec les structures des halogénures alcalins
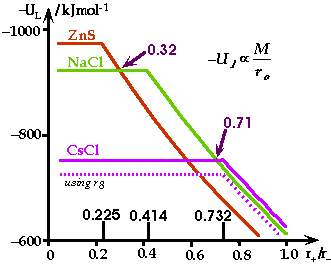
Energie de réseau
Question : Quelle est la coordination la plus élevée possible?
Réponse : Celle qui conduit au potentiel de Madelung le plus grand!
| Structure Type | Constante de Madelung |
| CsCl | 1.763 |
| NaCl | 1.748 |
| ZnS ( Wurtzite) | 1.641 |
| ZnS (Zinc Blende) | 1.638 |
Tracés de l'énergie coulombienne de Madelung en fonction du rapport des rayons ioniques
|
 |
Dépendance en pression des structures?
La compression des ions sous l'effet de la pression:-

L'ensemble ![]() laisse supposer que la structure
CsCl sera favorisée à haute pression
laisse supposer que la structure
CsCl sera favorisée à haute pression
e.g. RbCl subit une transition de phase NaCl
CsCl à 5~20kbar
Quand les règles des rapports de rayons fonctionnent, est-ce pour les bonnes raisons?
e.g. r(Ti4+)/r(O2-)
= 61 pm / 140 pm ( Pauling) = 0.44
Mais:
Nous devrions utiliser peut-être le rayon covalent pour le rayon de l'oxygène?
Une autre alternative de raisonnement ?
Ti dans TiO2 est en coordinence 6 car cela renforce la liaison covalente, et non parce que la règle des rapports de rayons est respectée!
Faites attention!
Utilisez les rapports de rayons comme un simple outil prédictif, non comme un moyen de justifier les structures
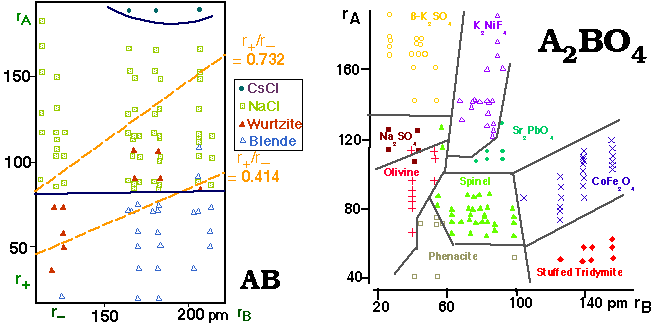
Y a-t-il une influence générale du rayon ionique sur la structure?
Diagrammes structuraux
Règle de Pauling n°2: Principe de la valence électrostatique ("Force de liaison")
i.e.Une structure ionique stable doit être arrangée de manière à conserver localement l'électroneutralité
(les ions sont entourés d'ions de charge opposée de manière à ne pas créer de grands volumes d'ins de charge identique dans le cristal - maximise le potentiel de Madelung!)
Force de liaison électrostatique (Electrostatic Bond Strength - e.b.s.)
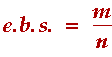
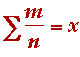
Pour un composé binaire AxBy les nombres de coordinations de A et B sont dans le rapport y:x
e.g. Fluorine,CaF2 Ca2+(8-coordiné), F- (4-coordiné)
e.g. Dans la Pérovskite , CaTiO3
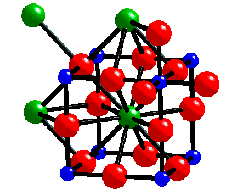
- O2- a une valence totale de 2
satisfaite par {4 x Ca2+(1/6)} +{2 x Ti4+(2/3)}
Chaque oxygène doit être commun à 4 cuboctaèdres CaO 12 & 2 octaèdres TiO6
- Cette information suffit pour définir de manière univoque l'arrangement structural idéal
Calcul de valence de liaison dans les solides 'réels'
Les polyèdres de coordination ne sont pas toujours réguliers - les structures précises montrent souvent un intervalle de distances.
Pour chaque liaison : 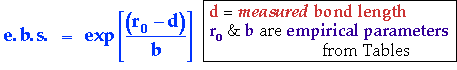
Valence =
CaCrF5: a des octaèdres CrF6 très distordus
Cr 2{F(1) 194 pm} + 2{F(2) 191.8 pm} + 2{F(3) 184.8 pm}
e.b.s. 2{0.42} + 2{0.46} + 2{0.65} = 3.06
Ca {F(1) 249 pm} + 2{F(2) 229.1 pm}+ 2{F(2) 239.1 pm} + 2{F(3) 224.4 pm}
e.b.s. {0.20} + 2{0.29} + 2{0.24} + 2{0.33} = 1.92
F(1) 2{Cr 194 pm} + {Ca 249 pm}
e.b.s. 2{0.42} + {0.20} = 1.02
F(2) {Cr 191.8 pm} + {Ca 229.1 pm} + {Ca 239.1 pm}
e.b.s. {0.46} + {0.29} + {0.24} = 0.99
F(3) {Cr 184.8 pm} + {Ca 224.4 pm}
e.b.s. {0.65} + {0.33} = 0.98
e.g. Que les sites d'une structure complexe contiennent bien les bons ions
Règle de Pauling n°3: Connexions des polyèdres
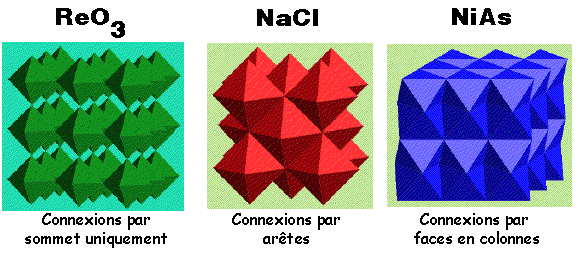
"Stabilité des structures selon différents types de connexion - par sommet > par arête > par face"
Pourquoi? Le partage des arêtes/faces rapproche les ions au centre de chaque polyèdre, ainsi, les répulsions électrostatiques augmentent
i.e. La répartition des ions de charge identique se fera de manière à minimiser l'énergie électrostatique entre eux
Exceptions ?
e.g. SiO2 = liaison par sommet mais SiS2 = liaison par arête
Règle de Pauling n°4: Séparation des cations
"Dans un cristal contenant différents cations, ceux de forte valence et faible coordinence ne partagent pas leur polyèdre avec les autres
e.g. Dans la Pérovskite , CaTiO3
| CaII en coordinence 12, les cuboctaèdres CaO12 partagent des arêtes | 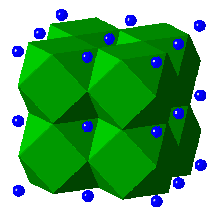 |
| TiIV en coordinence 6, les octaèdres TiO6 partagent seulement leurs sommets |  |
Règle de Pauling n°5: Homogénéité de l'environnement
"Le nombre de constituants de types différents dans un cristal a tendance à être faible"
i.e. autant que possible, des environnements identiques pour des atomes chimiquement identiques
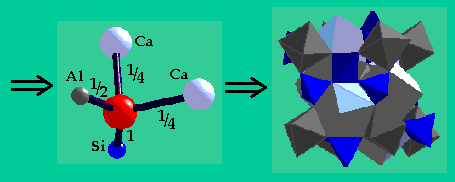
e.g. Considérons le minéral Grenat Ca3Al2Si3O12 comme un cristal ionique
|
|
Ca2+ |
Al3+ |
Si4+ |
|
coordination |
8 |
6 |
4 |
|
e.b.s. |
1/4 |
1/2 |
1 |
|
|
 |
Quand les règles de Pauling ne sont pas respectées
![]() Influences structurales sur la liaison
Influences structurales sur la liaison
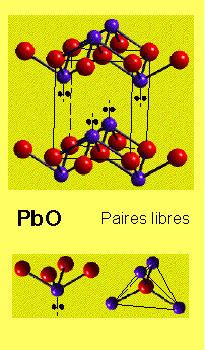
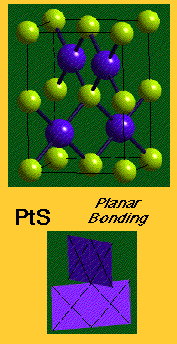
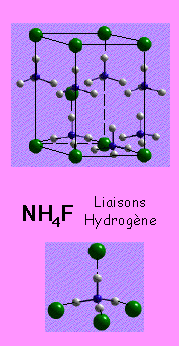
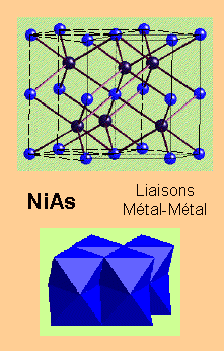
![]() C'est une évidence indirecte que ces structures ne
sont pas ioniques
C'est une évidence indirecte que ces structures ne
sont pas ioniques
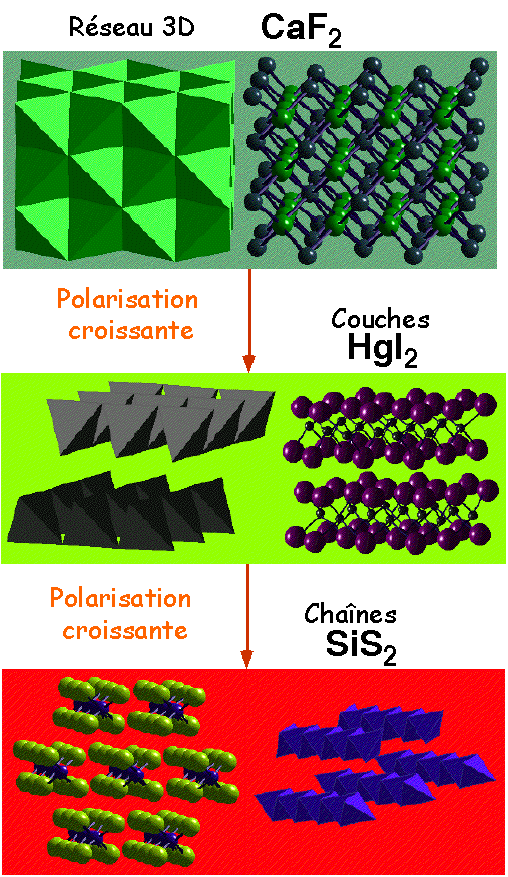
Augmentation de la polarisation dans la liaison ![]() basse dimensionnalité - couches/chaines
basse dimensionnalité - couches/chaines
Potentiel ionique A Z+/r+ (= pouvoir polarisant)
(La polarisabilité d'un anion est liée à la 'déformabilité' de son nuage électronique (sa "mollesse")
Une configuration électronique de gaz noble pour le cation
meilleur écrantage
moins de pouvoir polarisant
i.e. le facteur de charge en (1) devrait être la charge nucléaire effective
e.g. Hg2+ (r+ = 102 pm) est plus polarisant que Ca2+ (r+ = 100 pm)
Localisation des liaisons / Mesure de la covalence
Cela peut-il être utilisé pour justifier/prédire les structures?
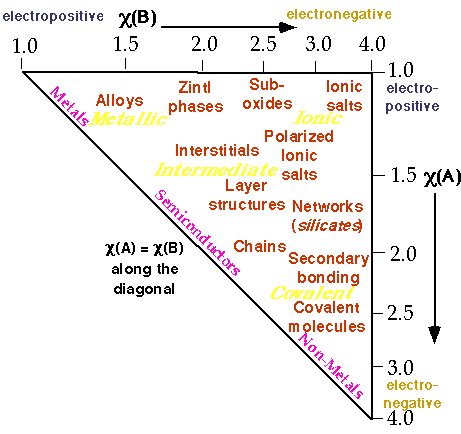
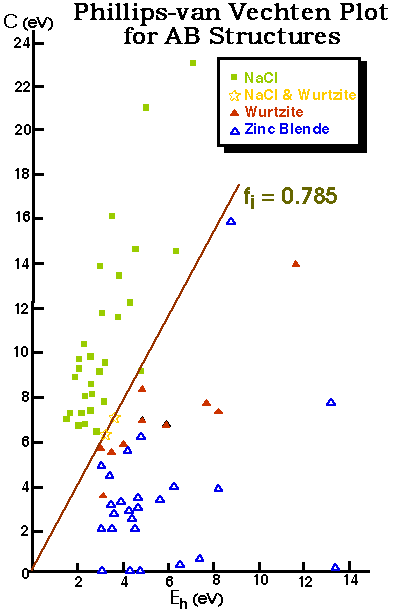
Combine la localisation des liaisons, la taille et l'électronégativité dans un diagramme de Structure
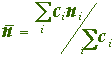
ci = no. d'atomes de i par unité formulaire
est relié àla localisation des liaisons
moins localisées
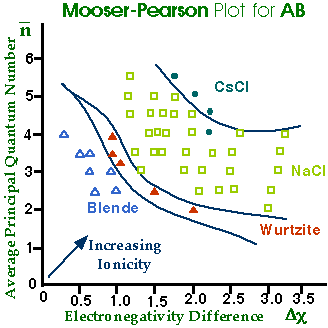
Graphe de Phillips-van Vechten
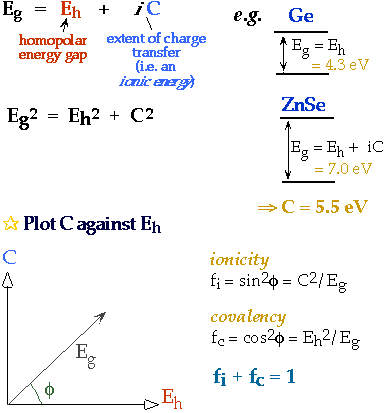

| |
Lecture 1 - Lecture 2 - Lecture 4 |
|
© S.J.Heyes, Oxford, 1996 Traduction -Adaptation: Pr C. Jacoboni, Université du Maine, 1998