Définition
Un composé de coordination résulte de l'association d'un cation métallique et d'anions (ou molécules) en nombre supérieur à celui fixé par la valence normale du cation.
Exemples :
$$\begin{align}& Ag_{aq}^{+}+2N{{H}_{3}}\,\,\,\rightleftarrows \,\,\,{{[{{H}_{3}}N\to Ag\leftarrow N{{H}_{3}}]}^{+}} \\& Ag_{aq}^{+}+2C{{N}^{-}}\,\,\,\rightleftarrows \,\,\,{{[N\equiv C\to Ag\leftarrow C\equiv N]}^{-}} \\& Cu_{aq}^{2+}+4N{{H}_{3}}\,\,\,\rightleftarrows \,\,\left[ \begin{matrix}N{{H}_{3}} \\\downarrow \\{{H}_{3}}N\to Cu\leftarrow N{{H}_{3}} \\\uparrow \\N{{H}_{3}} \\\end{matrix} \right]\,\,\,\,\,\,\,\,\,bleu\,\,fonc\acute{e} \\\end{align}$$
le cation est l'atome central,
les molécules ou ions sont les coordinats (ou ligands),
le nombre de liaisons formées par l'atome central est le nombre de coordination,
l'ion complexe est en général coloré (cas des cations de transition 3d ).
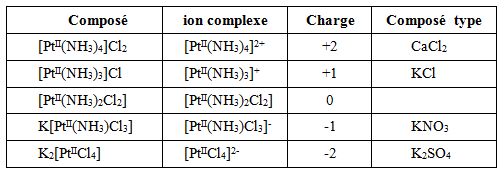
En solution aqueuse, la plupart des ions existent sous forme de complexes:
$C{{o}^{2+}}\,\,\,\rightleftarrows \,\,\,Co({{H}_{2}}O)_{6}^{2+}\,\,\,\,\,\,\,\,\,\,rose$
$A{{l}^{3+}}\,\,\,\rightleftarrows \,\,\,Al({{H}_{2}}O)_{6}^{3+}\,\,\,\,\,\,\,\,\,\,;\,\,\,\,\,\,\,Al(OH)_{4}^{-}\,\,\,\,(ou\,\,\,AlO_{2}^{-}\,\,)\,\,\,\,\,\,\,\,\,\,dans\,\,\,{{[Al{{(OH)}_{4}}{{({{H}_{2}}O)}_{2}}]}^{-}}\,\,\,\,\,\,\,\,\,\,\,incolores$
Les complexes se forment facilement pour les éléments 3d (surtout de $^{24}Cr\text{ }\grave{a}\text{ }{{\text{ }}^{30}}Zn$ ) et existent aussi pour les éléments post-transition comme Al, Ga, In - Sn, Pb - Bi..
Les études fondamentales sur la chimie de coordination sont dues à A. WERNER et S.M. JORGENSEN .




