Utilisation des complexes
En métallurgie : précipitation d'une espèce et maintien de l'autre en solution.
Exemple de la séparation Fer/Aluminium dans le traitement des bauxites :
$$F{{e}_{2}}{{O}_{3}}+A{{l}_{2}}{{O}_{3}}\xrightarrow{NaOH}F{{e}_{2}}{{O}_{3}}\downarrow +{{[Al{{(OH)}_{4}}{{({{H}_{2}}O)}_{2}}]}^{-}}$$
En photographie : La couche sensible contient des halogénures d'argent (AgBr, AgCl),
l'image latente résultant de l'exposition est révélée par un réducteur (hydroquinone) : $A{{g}^{+}}+\text{ }{{e}^{-}}\to Ag$ ( noircissement)
l'excès d'halogénures d'argent (non exposés et non révélés) est éliminé par complexation (complexe soluble) c'est la fixation :
$$AgB{{r}_{s}}+2{{S}_{2}}O{{_{3}^{2-}}_{aq}}\to [Ag{{({{S}_{2}}{{O}_{3}})}_{2}}]_{aq}^{3-}+Br_{aq}^{-}$$
Récupération des métaux nobles :
En présence d'air (${{E}_{0}}({{O}_{2}}/{{H}_{2}}O)=1.23\,V\,\,\,\,\,\Rightarrow E_{0}^{'}=0.81\,\,\ \grave{a}\,\ \,pH=8$), les métaux nobles Ag, Au, sont oxydés et complexés par les ions cyanures :
$$\begin{align}& Ag_{aq}^{+}+2C{{N}^{-}}\,\,\rightleftarrows \,\,Ag(CN)_{2}^{-}\,\,\,\,\,\,car\,\,\,\,\,\,{{E}_{0}}(Ag(CN)_{2}^{-}/Ag)=-0.44\,\,\ll \ \,E_{0}^{'} \\& Au_{aq}^{+}+2C{{N}^{-}}\,\,\rightleftarrows \,\,Au(CN)_{2}^{-}\,\,\,\,\,\,car\,\,\,\,\,\,{{E}_{0}}(Au(CN)_{2}^{-}/Au)=-0.61\,\,\ll \ \,E_{0}^{'} \\\end{align}$$
Pigments de coloration : Le ferrocyanure ferrique de potassium ($KF{{e}^{III}}[F{{e}^{II}}{{(CN)}_{6}}]$, bleu de prusse) est utilisé comme pigment.
Bains de galvanoplastie : les métaux à déposer de manière électrochimique sont d'abord maintenus en solution concentrée sous forme de complexes : $Au(CN)_{2}^{-}\,\,,\,\,\,Ni(CN)_{4}^{-}\,\,$
Chimie anti-tumorale (cancer) : Utilisation du complexe $Cis-\left[ P{{t}^{II}}{{\left( N{{H}_{3}} \right)}_{2}}C{{l}_{2}} \right]$ (le Trans est inactif). Son activité est liée à un échange possible des ligands Cl- (labiles) avec des atomes d'azote de l'ADN responsable de la reproduction cellulaire.
Traitement de l'empoisonnement par l'ingestion de plomb - saturnisme - (peintures, eau) : peut-être traité par utilisation du complexe
$$Ca-EDTA\text{ }(Ca{{Y}^{2-}}):Ca-EDT{{A}^{2+}}+P{{b}^{2+}}\to C{{a}^{2+}}+Pb-EDT{{A}^{2+}}\,\,\,\,(passe\,\,dans\,\,les\,\,urines)$$
Attention : l'EDTA seul est un poison car il complexe le calcium de l'organisme.
Les composés naturels :
Lhème combiné à la globine et l'eau forme un complexe octaédrique du fer (hémoglobine) qui est un constituant essentiel du sang. ($echanges\text{ }{{O}_{2}}/C{{O}_{2}}$ ) : $hemoglobine-{{H}_{2}}O+{{O}_{2}}\to hemoglobine-{{O}_{2}}+{{H}_{2}}O$.
L'eau et l'oxygène peuvent être remplacés par $C{{N}^{-}}~et\text{ }CO$ formant des complexes plus stables (rapidement mortels).
La chlorophylle est un complexe du magnésium.
Chimie analytique :
formation de complexe coloré (on suit la variation de densité optique à la longueur d'onde d'absorption)
$F{{e}^{3+}}+SC{{N}^{-}}\,\,\,_{\to }^{\leftarrow }\,\,\,FeSC{{N}^{+}}\,\,\,\,Rouge$, visible si c>10-5.5.
masquage de cation : $F{{e}^{3+}}+6C{{N}^{-}}\,\,\,_{\to }^{\leftarrow }\,\,\,Fe(CN)_{6}^{3-}\,\,\,\,ion\,\,ferricyanure\,\,\,\,p{{K}_{D}}=31$,
Fe3+ est masqué vis à vis des ions thiocyanates (pKD=3.1)
réaction de complexation : utilisation d'agents chelatants (EDTA) pour doser les cations en solution :
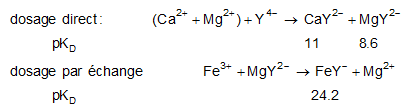
Dans chaque cas, il faut trouver un indicateur coloré pour voir la fin de réaction.




