Le carbone diamant
$${{d}_{C-C}}=\frac{a\sqrt{3}}{4}=1.544\,\mathring A \,\,\,et\,\,\,\,{{r}_{c}}=0.77\,\mathring A\,\,\,\,\,\,\,\,\,;\,\,\,\,\,\,\,\tau =\frac{4\times (2\cdot \frac{4}{3}\pi r_{c}^{3}}{{{a}^{3}}}=0.34$$ | 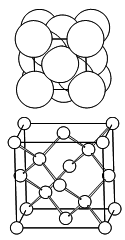 |
Le graphite
Il existe une autre variété du carbone, le graphite dont la structure, plus complexe, est formée par des feuillets de cycles hexagonaux de carbone (caractère bidimensionnel prononcé).
| 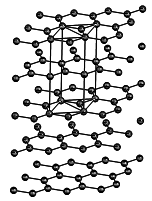 |
Remarque :
Les structures cristallines du carbone (type Diamant et Graphite) sont un bon exemple de corrélation entre la structure électronique des atomes et leur état physique et par conséquence leurs propriétés:
Le diamant est l'un des corps les plus durs et c'est un isolant électrique.
Le graphite est un des corps les plus mous (utilisé comme additif de lubrification ou comme palier anti-friction) et il est conducteur de l'électricité.




