Les structures-type AX
Introduction
Pour les composés possédant des atomes de nature différente, nous nous limiterons ici aux structures de type AX
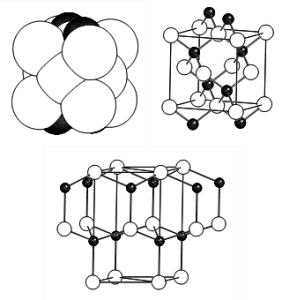
La structure Blende ZnS
La structure Blende ZnS. Maille cubique F, a = 5.409 Å, Z=4 (4 motifs ZnS). On peut décrire cette structure soit :
Sur la figure représentant les espèces avec leur taille respective réelle, on peut constater que les sphères de soufre réalisent un empilement assez compact justifiant la deuxième description. La coordinence des 2 espèces est tétraédrique mais on se contente généralement de définir la coordinence du métal : on citera donc la coordinence 4 du zinc. Une autre variété du sulfure de zinc ZnS, la Wurtzite, est connue (on parle de variété allotropique). La maille est hexagonale (a=3.811 Å, c=6.234 Å, Z=2). On peut remarquer que si ZnS blende est à relier à la structure Diamant (et à l'empilement de type c.f.c), ZnS Wurtzite est à relier à l'empilement hexagonal compact. A ce propos, l'utilisation de la notion d'empilement se fait sur la base d'un modèle de positions relatives identiques, car ces structures ne sont pas compactes. |
Simulation :
Complément : Evaluez votre compréhension
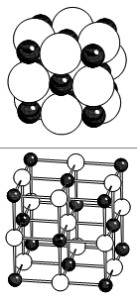
La structure NaCl
|  |
Simulation :
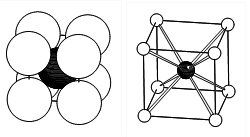
La structure CsCl
|  |