Introduction
Les édifices périodiques solides sont nombreux, cependant un certain nombre d'arrangements simples se retrouvent fréquemment.
La notion de structure-type concerne des édifices qui sont alors considérés comme des modèles connus.
Le type de structure adopté va dépendre de paramètres propres aux atomes ou ions concernés; 2 critères importants sont à considérer :
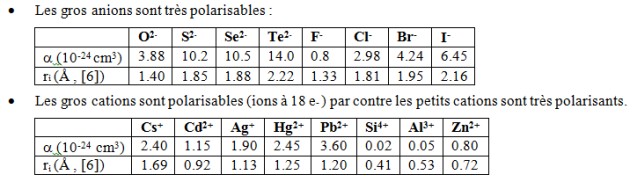
la polarisation des ions : (mesure : polarisabilité)
La polarisabilité : c'est l'aptitude d'un ion à se déformer sous l'influence du champ électrique dû à son entourage (anionique pour un cation ou vice et versa).
La déformation d'un ion est d'autant plus forte :
que le nombre d'ions de signe opposés qui l'entoure est petit ; la polarisation (déformation) d'un ion en coordinence [4] est plus grande que celle d'un ion en coordinence [8]
la charge de l'ion est élevée et son rayon important,
Un ion de faible rayon ionique et de forte charge est polarisant vis à vis des ions de grand rayon ionique et de faible charge (ion polarisable)
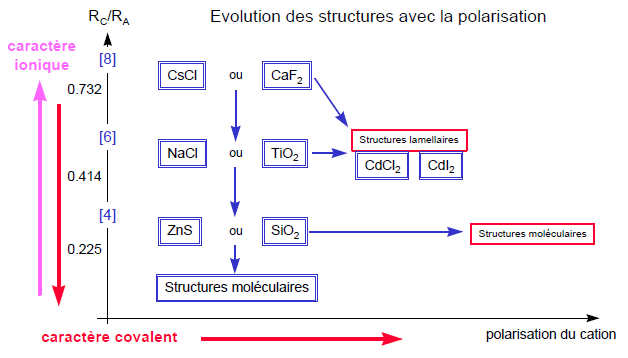
Le phénomène de polarisation entraîne une disparition du caractère sphérique des ions et une diminution de la distance entre les ions.
Utilisation de l'électronégativité comme critère :
Exemple de ZnS : ${{\chi }_{{{S}^{2-}}}}=2.5\text{ et }{{\chi }_{Z{{n}^{2+}}}}=1.6\text{ }\Delta \chi =0.9$ :
ZnS est à 38% covalent et 62% ionique.
Pour les structures AX :
si $\Delta \chi >2$ : caractère ionique
si $\Delta \chi <2$ : tendance à la covalence.
On a formation d'une liaison à caractère plus ou moins covalent : on parle de liaison iono-covalente (${{d}_{A-X}}<\sum{{{R}_{i}}}$).